水产动物自溶研究进展
水产动物自溶研究进展
郑 杰1,宋志远2,于 笛1,陈 冲1,*,袁成玉1,金文刚3
(1.辽宁省海洋水产科学研究院,辽宁大连 116023;2.大连海宝生物科技股份有限公司,辽宁大连 116045;3.陕西理工学院生物科学与工程学院,陕西汉中 723001)
水产动物资源由于水分含量大、自身酶系非常丰富,极易发生自溶,给其储藏、运输和加工过程带来很大不便,是制约水产加工业快速发展的重要瓶颈。本文重点从自溶影响因素、自溶过程生化变化、自溶机理和自溶技术应用四个方面对水产动物自溶的研究现状进行综述,并对未来的发展趋势和研究方向进行了展望,旨在为水产动物自溶的进一步研究提供理论参考。
水产动物,自溶,内源酶
自溶是指当机体受到物理因素(如热、辐射)、化学因素(如强酸、强碱、有毒物质)和生物因素(如病原体)等环境因素的刺激后,诱发自身酶系将自身的组织结构破坏、降解,从而引起自身死亡的现象[1]。自溶现象在自然界广泛存在,如动物自溶、植物自溶和微生物自溶等,但不同物种其自溶的定义也有所不同。水产动物通常具有水分含量大、自身酶系非常丰富的特点,因此极易发生自溶现象。水产动物的自溶是指水产动物通过自身体内丰富的酶系成分,在一定条件下使其自身水解的过程[2]。目前,在海洋资源开发和利用已经成为全球各国共同关注的焦点的背景形势下,国内外学者对水产动物尤其是海参、鱼、虾和贝类等及其加工副产物的自溶进行了广泛而深入的研究。本文在总结归纳国内外对水产动物自溶的研究成果的基础上,重点从自溶影响因素、自溶过程生化变化、自溶机理和自溶技术的应用等四个方面对水产动物自溶的研究现状进行概述,以期为水产动物自溶的研究提供一些新的思路,进而对海洋生物资源的开发利用起到一定的指导和借鉴作用。
1 自溶的影响因素
水产动物自溶是一个系统而又复杂的过程,通常会受到外界环境条件和各种物理化学因素的影响和制约。国内外学者一般采用蛋白质水解度、TCA-可溶性寡肽的含量[3]、可溶性固形物的含量和氨基态氮的变化等作为指标来考察各种因素对水产动物自溶过程的影响,并通过正交实验、响应面模型等对水产动物自溶条件进行优化,以求能够实现对自溶过程的有效控制。
1.1 样品预处理对自溶过程的影响
在水产品加工过程中,为了改善产品的生产工艺和提高产品质量,通常会采用一些不同的技术工艺对原料进行预处理。不同的预处理方式会对水产动物自溶产生不同程度的影响,如经过去皮和水洗之后,绯鲵鲣鱼中内源性蛋白酶的含量和活性均有所下降,导致其自溶程度明显降低[4],相反经过紫外线照射和超声波处理后,亨氏仿对虾和刀额新对虾及鱿鱼内脏等的内源性蛋白酶被激活,使其自溶速度加快,蛋白质水解率显著提高[5-7]。但是,紫外线照射时间过长或者超声波处理时的功率过高均会使内源酶变性失活,从而对水产动物的自溶过程产生抑制作用。
1.2 环境因子对自溶过程的影响
在能够影响水产动物自溶过程的众多环境因子中,温度和pH的影响最为显著。部分水产动物自溶的最适温度和最适pH如表1所示。大多数水产动物及其加工副产物自溶的最适温度为40~65℃,最适pH为6~8,但是也有例外,如绯鲵鲣鱼鱼肉、鱿鱼内脏和南极磷虾自溶的最适pH则在酸性或碱性较强的pH范围内,分别为4.0、4.5和8.74。温度和pH等环境因子对自溶过程的影响呈现出与外源酶酶解相类似的变化趋势,而且最适宜条件与从水产动物体内制备得到的某些内源酶的酶学性质的研究结果相一致,从而为水产动物自溶机理的研究提供了一定的思路。
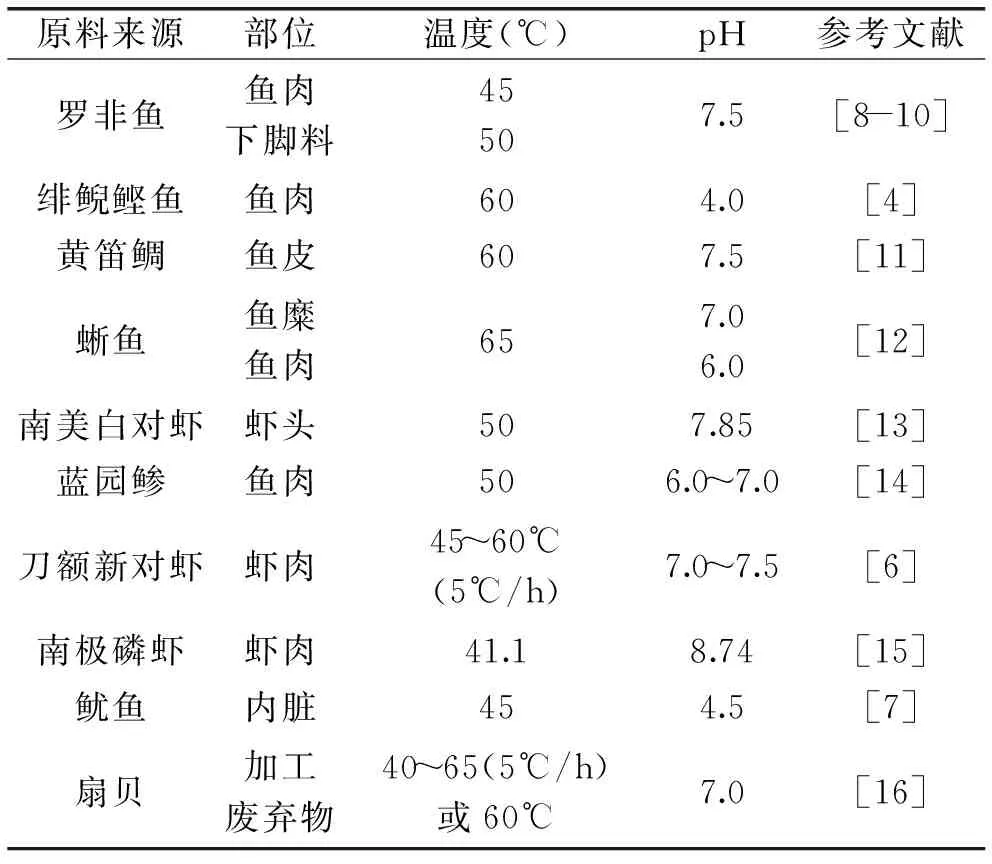
表1 部分水产动物自溶的温度和pHTable 1 Autolysis temperature and pH of some marine animals
1.3 外源性添加物对自溶过程的影响
在生产过程中,添加食品添加剂是为了能够获得质量较高产品而经常采用的一种技术手段。为此,许多学者对多种常用食品添加剂对水产动物自溶过程的影响进行了考察,结果发现,不同种类添加剂对自溶过程有不同程度的影响,而且其作用大小随添加量的变化而变化,如在葡萄糖≤2.00%、氯化钠≤10%和柠檬酸≤0.10%的添加量范围内,对罗非鱼蛋白自溶有一定程度的促进作用,超过该范围则显示抑制作用[9]。除此之外,其他外源性添加物如鸡浆提取物[17]、花生蛋白分离物[18]、乳清蛋白浓缩物(WPC)[19]、卵清蛋白(EW)[20]、牛血浆蛋白(BPP)[21-22]和金属离子[5]等也可以影响水产动物的自溶过程,而且其影响作用的大小也与添加量有一定的相关性。
2 自溶过程中的生化变化
水产动物自溶过程中,自身所含游离性小分子物质逐渐得到释放,同时,在丰富内源酶酶系的作用下,大分子的物质逐渐被降解成为小分子物质如肽和氨基酸等。水产动物自溶过程中的生化变化主要体现在α-氨基氮含量、可溶性总氮含量、蛋白质回收率、氨基氮转化率、总酸、游离氨基酸和游离脂肪酸等方面,也有研究人员对自溶过程中水分的变化规律进行了研究[23]。不同水产动物自溶过程中主要化学成分的变化规律基本类似,大都随着自溶时间的延长而呈现先逐渐增加后趋于稳定的趋势,但具体变化规律与自溶的条件有关,如徐伟[24]等对不同条件下鳀鱼自溶水解过程中生化变化规律的研究表明,在室温(26℃)条件下,鳀鱼自溶水解的最佳时间为12h,在初始pH为9.0的条件下,自溶水解液中的α-氨基氮含量、可溶性总氮含量、蛋白质回收率和氨基氮转化率均较高。
3 自溶的机理
水产动物体内通常含有各种各样的水解酶,水产动物的自溶主要是由于其体内的碳水化合物、脂肪和蛋白质被自身的磷酸酶、脂肪酶、组织蛋白酶和肠酶等水解所引起的,其中,起主要作用的是内源性蛋白酶类。有研究表明,组织蛋白酶B、H和L在降解内源性蛋白质和外源性蛋白质中起到至关重要的作用。因此,国内外学者主要采用外源添加各种蛋白酶抑制因子的手段,从自溶酶尤其是内源性蛋白酶的角度对蓝园鲹、鲢鱼、绯鲵鲣鱼、蜥鱼和南美白对虾等的自溶机理进行了研究,发现在不同种类水产动物自溶过程中起主要作用的内源性酶类有所不同,对其自溶过程起到抑制作用的因子也不尽相同(见表2)。通常所选用的外源蛋白酶抑制因子为TLCK、TPCK、E-64、Antipain和胰蛋白酶抑制剂及胃蛋白酶抑制剂等。酶在水产动物自溶过程中的作用并不是相互独立的,而是以协同作用的方式进行的,而且一定程度上也会受到外部环境的影响,如在鱼死后的僵直阶段,渗透压和离子强度的增高会导致肌原纤维强度的减弱,从而导致其更易发生降解[29]。虽然已经从众多水产动物体内分离出了组织蛋白酶B[30]和类半胱氨酸蛋白酶[31]及类组织蛋白酶L[32]等内源蛋白酶,也证实了其在自溶过程中起重要作用,但由于水产动物体内内源酶系非常复杂,至于某种或某类内源性蛋白酶在自溶过程中所起到的具体作用,仍需要进行进一步的探讨。

表2 与水产动物自溶相关的部分酶类与抑制因子Table 2 Enzymes and inhibitors related with marine animals autolysis
4 自溶技术的应用
水产动物由于其通常具有水分含量高、酶系丰富的特点而极易发生独特的自溶现象,然而长期以来,其体内广泛存在的这种多酶自溶体系一直未得到有效的控制和利用,直到近些年来才逐渐有了改善。由于自溶技术具有成本低、操作简单和对环境无污染的优点,目前,其已经被广泛的应用于水产动物中生物活性物质的分离制备、营养成分的回收利用以及相关产品的开发等。
4.1 在生物活性物质制备方面的应用
利用自溶技术或自溶结合外源酶酶解技术制备生物活性肽已经成为水产动物活性肽制备的主要技术手段。研究人员已经采用自溶技术从凡纳滨对虾、海参肠和太平洋无须鳕鱼中分别得到了具有ACE抑制活性的肽[33]和具有抗氧化活性的自溶水解物[34-35]。此外,侯佰立[36]和姜淼[37]等采用自溶法,分别从凡纳滨对虾的虾头和虾壳中提取得到了甲壳素和虾青素。
4.2 在营养成分回收利用方面的应用
采用自溶技术可以实现水产加工副产物中营养成分的有效回收利用,在使原料价值得到最大化利用的同时,也避免了对环境造成污染,如钱俊青[38]等采用自溶法对黄鲇鱼内脏中的鱼油进行了回收利用;Liu C C[39]等则采用自溶技术对圆花鲭加工废弃物中的蛋白成分进行了回收,且发现相比外源酶酶解法而言,自溶法的蛋白回收率较高;Senphan[40]等采用自溶技术从南美白对虾的肝胰腺中提取脂肪,发现60℃自溶60min可以增加脂肪的提取率,而且对脂肪的质量无任何不良影响。
4.3 在产品开发方面的应用
人们最初只能利用自溶来简单改善食品原料的风味和质构,任其自溶过程缓慢的进行,如传统的鱼露和虾油的生产等。随着多年研究的不断积累,人们开始逐渐利用自溶来开发一些新的产品,如Liu C C[39]等将通过自溶技术取得的低温自溶回收物进行活性炭脱苦后制成了一种全天然的、可以用于替代味精的增鲜剂;章超桦等[41]采用虾组织快速自溶新技术对刀额新对虾蛋白质进行水解,经减压浓缩和适当调配后制得2种天然海鲜调味料一黑虾油和虾味沙司。
5 总结与展望
水产资源通常营养物质含量较高,尤其是海洋动物资源,由于其独特的高压、高盐的生存环境而使其具备许多特殊的生理活性,因此成为国内外科研人员研究的重点。有关水产动物自溶的研究已经有很多,涉及的原料来源有太平洋鳕鱼、凡纳滨对虾、刀额新对虾、海参、扇贝、鱿鱼、黄鲇鱼和南美白对虾等,其中,各种鱼类和虾类是研究的主要对象。原料形式包括可食部位和加工副产物两个部分,但是,随着相关企业降低成本和使原料价值最大化的需求越来越迫切,研究人员也将重点放在了水产动物加工副产物方面(如鱼头、内脏等)。近些年来,人们已经可以从宏观角度对水产动物自溶过程实现较为有效的控制,并将其充分运用到水产加工企业的实际生产过程中,成为产品开发的一种重要技术手段。
水产动物的自溶过程非常复杂,所发生的生化变化主要是由内源酶系对蛋白和结构组织的降解所导致的,在这一过程中起作用的酶类主要有具有多催化活性的蛋白酶体、溶酶体酶(包括天冬氨酸蛋白酶和组织蛋白酶等)、钙激活酶、氨基肽酶、碱性蛋白酶和结缔组织水解酶如弹性蛋白酶和胶原酶等。虽然目前已经从自溶酶的角度对水产动物自溶过程的机理进行了较多研究,奠定了一定的基础,但是每种酶在自溶过程中的确切作用目前尚不明确。同时,由于水产动物自溶过程中可能会存在细胞自吞噬现象[42],还应该利用细胞生物学和分子生物学手段分别对自溶过程中的超微细胞结构变化和起关键作用的自溶酶基因及其调节作用机制进行进一步的研究,以便从微观角度更好的揭示自溶这一特殊生理现象的本质。
[1]启航. 海参体壁酶的研究[D].大连:大连轻工业学院,2007.
[2]郑杰. 海参自溶过程中生化变化及抗氧化活性寡肽的研究[D].镇江:江苏大学,2012.
[3]郑杰,吴海涛,董秀萍,等. 基于主要化学成分变化建立的海参自溶评价指标[J]. 大连工业大学学报,2010,29(6):391-395.
[4]Yarnpakdee S,Benjakul S,Visessanguan W,et al. Autolysis of goatfish(Mulloidichthysmartinicus)mince:Characterisation and effect of washing and skin inclusion[J]. Food Chemistry,2009,114(4):1339-1344.
[5]章超桦,邓尚贵,杨丽明,等. 紫外线和温度对虾快速白溶的影响-水产品快速自溶影响因素探讨之一[J]. 湛江海洋大学学报,1994,14(2):51-56.
[6]章超桦,邓尚贵. 刀额新对虾的快速自溶技术[J]. 水产学报,1999,23(4):387-391.
[7]司伟兰,辛绮婷,余颖儿,等. 鱿鱼内脏成分分析及自溶条件的研究[J]. 农产品加工·学刊,2010(8):11-14.
[8]黄冬香,李林,于新. 罗非鱼蛋白自溶水解条件优化[J]. 西南大学学报:自然科学版,2009,31(5):93-97.
[9]黄冬香,于新,李林. 食品添加剂对罗非鱼蛋白自溶作用的影响[J]. 食品科学,2010,31(5):73-77.
[10]孔美兰,吉宏武,章超桦. 罗非鱼下脚料自溶条件的初步探讨[J]. 湛江海洋大学学报,2005,25(4):27-31.
[11]Intarasirisawat R,Benjakul S,Visessanguan W,et al. Autolysis study of bigeye snapper(Priacanthusmacracanthus)skin and its effect on gelatin[J]. Food Hydrocolloids,2007,21(4):537-544.
[12]Yongsawatdigul J,Piyadhammaviboon P. Inhibition of autolytic activity of lizardfish surimi by proteinase inhibitors[J]. Food Chemistry,2004,87(3):447-455.
[13]曹文红,章超桦,洪鹏志,等. 响应面法优化南美白对虾虾头自溶工艺的研究[J]. 中国食品学报,2009,9(1):158-164.
[14]崔春,赵谋明,林伟锋. 蓝园鲹快速自溶机理研究[J]. 食品工业科技,2005,26(2):85-87.
[15]薛勇,赵明明,王超,等. 响应面法优化南极磷虾蛋白自溶工艺的研究[J]. 食品工业科技,2012(4):346-348,373.
[16]郑丽,汪秋宽,谢智芬,等. 扇贝加工废弃物自溶技术的研究[J]. 大连水产学院学报,2007,22(1):49-52.
[17]Rawdkuen S,Benjakul S,Visessanguan W,et al. Fractionation and characterization of cysteine proteinase inhibitor from chicken plasma[J]. Journal of Food Biochemistry,2005,29(5):486-503.
[18]Oujifard A,Benjakul S,Ahmad M,et al. Effect of bambara groundnut protein isolate on autolysis and gel properties of surimi from threadfin bream(Nemipterusbleekeri)[J]. LWT-Food Science and Technology,2012,47(2):261-266.
[19]Rawdkuen S,Benjakul S. Whey protein concentrate:Autolysis inhibition and effects on the gel properties of surimi prepared from tropical fish[J]. Food Chemistry,2008,106(3):1077-1084.
[20]Yongsawatdigul J,Piyadhammaviboon P. Inhibition of autolytic activity of lizardfish surimi by proteinase inhibitors[J]. Food Chemistry,2004,87(3):447-455.
[21]Benjakul S,Visessanguan W,Tueksuban J,et al. Effect of some protein additives on proteolysis and gel-forming ability of lizardfish(Sauridatumbil)[J]. Food Hydrocolloids,2004,18(3):395-401.
[22]Eakpetch P,Benjakul S,Visessanguan W,et al. Autolysis of pacific white shrimp(Litopenaeusvannamei)meat:characterization and the effects of protein additives[J]. Journal of Food Science,2008,73(2):S95-S103.
[23]仪淑敏,王雪琦,纪晓林,等. 刺参自溶过程中水分变化规律的研究[J]. 食品工业科技,2014,35(11):49-51,56.
[24]徐伟,于刚,薛勇. 鳀鱼自溶水解过程的生化变化[J]. 食品科技,2010(4):136-139.
[25]李树红,张楠,刘欢,等. 鲢鱼背肌肌原纤维蛋白自溶与内源组织蛋白酶 B,L,H的关系[J]. 中国农业大学学报,2004,9(5):71-75.
[26]Yamashita M,Konagaya S. Differentiation and localization of catheptic proteinases responsible for extensive autolysis of mature chum salmon muscle(Oncorhynchus keta)[J]. Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1992,103(4):999-1003.
[27]Aoki T,Ueno R. Involvement of cathepsins B and L in the post-mortem autolysis of mackerel muscle[J]. Food Research International,1997,30(8):585-591.
[28]Kubota M,Kinoshita M,Kubota S,et al. Possible implication of metalloproteinases in post-mortem tenderization of fish muscle[J]. Fisheries Science,2001,67(5):965-968.
[29]Delbarre-Ladrat C,Cheret R,Taylor R,et al. Trends in postmortem aging in fish:Understanding of proteolysis and disorganization of the myofibrillar structure[J]. Critical Reviews in Food Science and Nutrition,2006,46(5):409-421.
[30]Sun L M,Zhu B W,Wu H T,et al. Purification and characterization of cathepsin B from the gut of the sea cucumber(Stichopusjaponicas)[J]. Food Science and Biotechnology,2011,20:919-925.
[31]Qi H,Dong X P,Cong L N,et al. Purification and characterization of a cysteine-like protease from the body wall of the sea cucumberStichopusjaponicus[J]. Fish Physiology and Biochemistry,2007,33:181-188.
[32]Zhou D Y,Chang X N,Bao S S,et al. Purification and partial characterisation of a cathepsin L-like proteinase from sea cucumber(Stichopusjaponicus)and its tissue distribution in body wall[J]. Food Chemistry,2014,158:192-199.
[33]郝更新,章超桦,曹文红. 对虾蛋白自溶制备ACE 抑制肽的工艺条件优化[J]. 湛江海洋大学学报,2006,26(4):59-62.
[34]郑杰,吴海涛,朱蓓薇,等. 海参肠自溶水解物抗氧化活性的研究[J]. 大连工业大学学报,2011,30(5):313-317.
[35]Samaranayaka A G P,Li-Chan E C Y. Autolysis-assisted production of fish protein hydrolysates with antioxidant properties from Pacific hake(Merlucciusproductus)[J]. Food Chemistry,2008,107(2):768-776.
[36]侯佰立,吉宏武,王燕,等. 凡纳滨对虾虾头制备甲壳素工艺的研究[J]. 食品工业科技,2011,(10):273-276.
[37]姜淼,杨贤庆,李来好,等. 内源酶辅助提取虾壳虾青素的研究[J]. 南方水产科学,2011,7(2):55-60.
[38]钱俊青,单昱东,廖启元. 黄鲇鱼内脏自溶酶解提取鱼油的工艺[J]. 食品与发酵工业,2009,35(12):66-69.
[39]Liu C C,Morioka K,Itoh Y,et al. Autolysis:An effective way to recover protein from fish solid wast[J]. Journal of Shanghai Fisheries University,2003,12(suppl):71-77.
[40]Senphan T,Benjakul S. Compositions and yield of lipids extracted from hepatopancreas of Pacific white shrimp(Litopenaeusvannamei)as affected by prior autolysis[J]. Food Chemistry,2012,134(2):829-835.
[41]章超桦,邓尚贵. 虾组织快速自溶技术在海鲜调味料生产上的应用研究[J]. 食品与发酵工业,2000,26(2):36-39.
[42]Zhu B W,Zheng J,Zhang Z S,et al. Autophagy plays a potential role in the process of sea cucumber body wall “melting” induced by UV irradiation[J]. Wuhan University Journal of Natural Sciences,2008,13(2):232-238.
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

