论文:混养模式对鲫生长、存活、免疫酶活性和水质的影响
混养模式对鲫生长、存活、免疫酶活性和水质的影响
林听听1,么宗利1,周凯1,来琦芳1,李功政2,厉成新2,高鹏程1,王礼虎2,魏建中2
(1.中国水产科学研究院东海水产研究所,中国水产科学研究院盐碱地渔业工程技术研究中心,上海200090;2.上海市上海农场海丰水产养殖有限公司,江苏盐城224153)
根据多营养层次综合养殖原理,2011年4月16日至11月15日在面积33.3km2,水深2.5m,盐度0.5~0.7,碳酸盐碱度2.5~2.7mmol·L-1池塘中,研究三种不同混养模式下异育银鲫Carassius auratus gibelio存活、生长、免疫相关酶活及水质变化:模式A主养鲫,混养鲢Hypophthalmichthys molitrix和鳙Aristichthys nobilis;模式B主养鲫和鳊Parabramis pekinensis,混养鲢和鳙;模式C主养鲫和草鱼Ctenopharyngodon idella,混养鲢和鳙,为探索异育银鲫池塘生态高效养殖提供参考。养殖期间,每月定期监测池塘的水质,养殖结束后称量鲫的体质量,统计产量,计算存活率,并检测血清和肝胰脏中的过氧化物酶(POD)和超氧化物歧化酶(SOD)活力。结果显示:模式C的pH在养殖前期要高于模式A和模式B,但氨氮、亚氮、活性磷、叶绿素a大部分时间内要显著低于后两者;模式A和模式B的水质变化趋势基本相同。模式A和模式C鲫平均体质量分别达(508.5±26.5)和(516.5±35.0)g,显著高于模式B的(473.0±31.5)g;三者间存活率存在显著差异,模式A最高(95.14±1.47%),模式C最低(86.28±2.16%);模式A血清和肝胰脏中的SOD显著高于模式B和C;模式A血清中的POD水平也很高,与模式B无显著差异,但显著高于模式C。结论:模式A中的鲫生长速度更快,存活率更高,抗氧化能力更强,模式A相较于模式B和C鲫养殖效果更佳。
异育银鲫;混养;水质;生长存活;抗氧化酶
异育银鲫Carassius auratus gibelio生长快、市场需求旺盛、价格稳定、养殖效益高,是我国鲫养殖的主要品系,养殖规模和面积不断扩大[1]。然而近年来,由于养殖观念、养殖模式和养殖技术等不足,出现鲫生长缓慢、商品鱼规格偏小、低产或产量不稳定等问题[2],甚至出现爆发性病害[3,4],以及药残[5]和食品安全问题,亟需探索低碳集约养殖技术和高效生态的养殖模式。
多营养层次综合水产养殖(Integrated Multi-Trophic Aquaculture,IMTA)是根据生态平衡、物种共生互利和对物质多层次利用等生态学原理,人为地将不同生活习性和食性的多个养殖对象按适宜比例关系在同一水体中养殖的生产形式[6]。这种养殖方式能丰富养殖种类,有效利用养殖空间,稳定养殖环境,促进生态平衡,加速养殖水体中能量和物质的循环,增强养殖动物对环境突变或病原侵袭的抗逆力[7,8]。王小冬等[9]的试验表明:在三角帆蚌Hyriopsis cumingii养殖池中混养异育银鲫能促进I龄蚌的生长,而混养鲢Hypophthalmichthys molitrix和鳙Aristichthys nobilis则能促进2龄蚌的生长。赵广学等[10]也发现:在凡纳滨对虾Litopenaeus vannamei池中混养一定数量的鱼、贝、植物等能很好地改善池塘养殖环境,促进对虾生长,提高亩产量;在综合养殖模式中混养泥鳅Misgurnus anguillicaudatus,较斑点叉尾鮰Ietalurus punetaus和罗非鱼Oreochromis spp.更适合于对虾的生长。
本试验以上海市海丰水产养殖有限公司的标准化池塘为试验点,研究一个养殖周期内不同混养模式下的水质及异育银鲫生长、存活、抗氧化相关酶的活性变化,以期为探索异育银鲫池塘生态高效养殖提供参考。
1 材料与方法
1.1 试验池塘
试验池塘均为壤土底质、长方形标准化池塘,面积33.3km2,塘深3.0m。试验前排干池水,冬天冻晒,清除杂物与过多淤泥。冻晒后注水,水深2.5m,盐度0.5~0.7,碳酸盐碱度2.5~2.7mmol·L-1。每塘配有3台3.5kw增氧机和2台自动投饵机。
1.2 试验用鱼
异育银鲫、鳊、草鱼、鲢、鳙种购自常州市武进名优水产引繁推广中心(常州市武进水产养殖场),体质健壮,鳞片完整,无伤病和畸形。放养苗种的规格、数量和比例见表1。
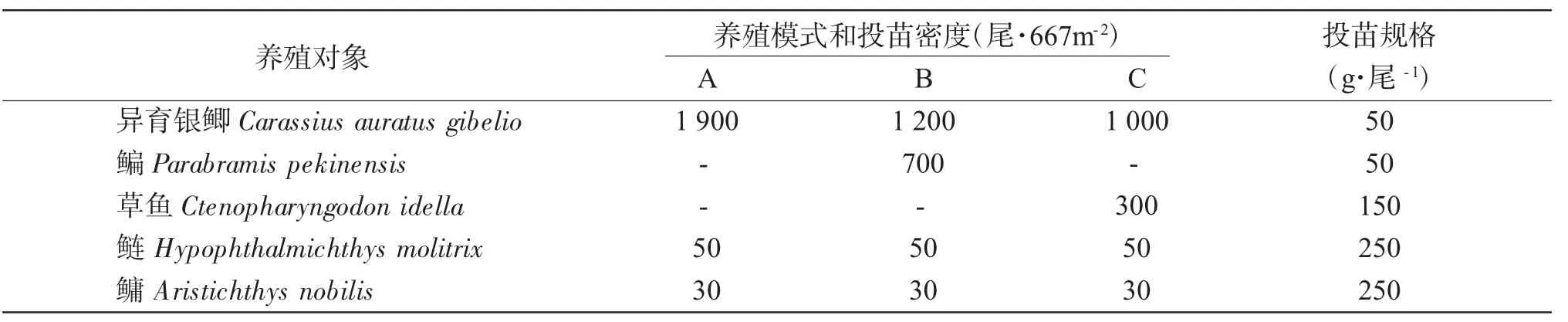
表1 试验池塘的放养情况Tab.1Stocking in the experimental ponds
1.3 试验设计
在相邻的9个标准化池塘中设3个混养模式,每个模式3个重复。模式A:主养鲫,混养鲢和鳙;模式B:主养鲫和鳊,混养鲢和鳙;模式C:主养鲫和草鱼,混养鲢和鳙(表1)。4月中旬放苗至11月中旬捕获,养殖8个月。
1.4 养殖管理
每天至少巡塘两次,观察水色和鱼的摄食、游动状态,及时处理浮头和病鱼;每天根据天气、水色开启增氧机,开机累计时间不少于7h,尤其在高温时,7~9月开机时间不少于11h;每隔15~20d泼洒一次10%的二氧化氯;每隔15~20d泼洒一次以浓缩光合细菌为主的微生态制剂,每667m280g。
饲料购自安徽天邦饲料科技有限公司,粗蛋白25%~30%、粗脂肪4%~7%、碳水化合物40%、纤维素8%~10%。每天08:00、10:30、14:30和17:00时,定位、定量由自动投饵机投喂。日投喂量为鱼总体质量的5%左右。
1.5 指标检测
1.5.1 水质指标检测
放养后,每月中旬采集各塘的水样一次,检测温度、pH、氨氮、亚硝氮、硝氮、活性磷、总磷、化学耗氧量(COD)和叶绿素a含量。其中氨氮采用奈氏试剂比色法、亚硝氮采用萘胺盐酸盐比色法、硝氮采用锌-镉还原法、活性磷和总磷采用磷钼蓝法、COD采用高锰酸钾法[11]测定,叶绿素a采用多参数水质分析仪(YSI 6600V)测定。
1.5.2 鲫总产量、平均体重及存活率检测
捕获时,每塘随机抽取20尾鲫,测量体质量。待全塘鱼捕获完全后,统计各塘的鲫总产量。鲫存活率计算公式为:(每塘鲫总产量/平均每尾鲫体质量/每塘放养鲫鱼种总尾数)×100%。
1.5.3 抗氧化酶活力检测
每次测定完鱼体质量后,用含有抗凝剂的注射器从尾静脉抽血,血液于4℃2500 r·min-1离心5min,取上清液于冻存管,液氮冻存;抽完血后,取鲫肝胰脏,分装,液氮冻存。采集的肝胰脏化冻后剪碎,加入9倍于其重量的PBS,用Kinematica匀浆机冰浴6000r·min-1匀浆2min。匀浆液于4℃3500r· min-1离心10min,取上清液,再于4℃8000r·min-1离心10min,继而取中层液(上层为油脂,下层为组织碎片液),连同化冻的血清用于检测超氧化物歧化酶(SOD)和过氧化物酶(POD)活力。
采用南京建成生物工程研究所试剂盒及其操作说明书检测酶活力。SOD活力单位定义为:每毫克组织蛋白在1mL反应液中SOD抑制率达50%时所对应的SOD量为1个活力单位;POD活力单位定义为:每毫克组织蛋白每分钟催化产生1μg底物的酶量为1个活力单位。采用考马斯亮蓝G-250法测定组织蛋白质含量[12],以牛血清白蛋白为标准蛋白绘制标准曲线,根据组织蛋白的OD595的吸光值和标准曲线,计算出组织蛋白的含量(mg·mL-1)。
1.6 数据分析
所得数据以3个平行组数据的平均值±标准差(Mean±SD)表示,采用SPSS 16.0统计软件进行数据处理和分析。利用单因素方差分析(One-Way ANOVA)结合Duncan多重比较分析三个养殖模式间的差异,P<0.05为差异显著。采用Origin 8.0软件制图。
2 结果与分析
2.1 养殖期间水质变化
整个养殖周期内,各模式间的温度和DO差异不显著(P>0.05)。模式C大部分时间内pH显著高于模式A和B(P<0.05),特别是养殖前期(6月和7月),甚至超过了9;6月份模式B pH显著高于模式A,其余时间模式A和B变化趋势相似,均随着养殖周期的延长缓慢上升(图1)。三模式氨氮含量的变化趋势相同,只是在6~8月份期,模式C显著低于模式A和B(P<0.05),9月份三者均达到峰值(图1)。除9月份之外,其余时间内模式C的亚硝氮含量显著低于另两者(P<0.05)。同样,模式A和B之间变化趋势相似(图1)。养殖初期三模式硝氮含量均较低,7月份后模式A和B开始急剧上升,模式B的上升幅度不及模式A,而模式C则于9月份之后才急剧上升,三者于11月份达到一致水平(图1)。
养殖早中期(6~8月),模式C活性磷含量显著低于模式A和B(P<0.05),而在10月份,模式B和C则显著高于模式A(P<0.05)(图2)。除了8月份,模式C总磷含量显著低于模式A和B之外(P<0.05),剩余时间三者的变化趋势相同,无显著差异(图2)。在整个养殖周期内,三种模式化学耗氧量的变化趋势相同,无显著差异(图2)。模式A和模式B从8月份以后叶绿素a含量开始快速上升,模式A的上升幅度不及模式B;模式C一直保持较低水平(图2)。
在整个养殖周期内,硝氮、活性磷、总磷、化学耗氧量、叶绿素a含量逐渐上升。
2.2 鲫总产量、平均体质量及存活率
捕获后,模式A和B的总产量分别为(1.065± 0.083)t·667m-2和(1.135±0.121)t·667m-2,两者无显著差异(P>0.05),均显著高于模式C的(0.743± 0.065)t·667m-2(P<0.05)(表2)。模式A和C鲫的平均体质量分别为(508.5±26.5)g和(516.5±35.0)g,两者无显著差异(P>0.05),但均显著高于模式B的(473.0±31.5)g(P<0.05);三者的存活率两两间存在显著差异(P<0.05),模式A最高(95.14±1.47)%,而模式C最低(86.28±2.16)%。
2.3 鲫抗氧化酶活力的变化
2.3.1 POD活力
血清中,模式A和B的POD活力分别为(55.60±11.78)U·mg-1prot min-1和(63.21±3.91)U· mg-1prot min-1,两者间无显著差异(P>0.05),但均显著高于模式C的(41.33±6.28)U·mg-1prot min-1(P<0.05)(图3);而在肝胰脏中,三种模式的POD活力基本维持在同一水平(314.83~337.87 U·mg-1prot min-1)(P>0.05)。
2.3.2 SOD活力
模式A血清和肝胰脏中SOD的活性均显著高于模式B和C(P<0.05),而模式B和C则无显著差异(P>0.05)(图3)。
3 讨论
3.1 不同养殖模式下的水质变化

图1 在整个养殖周期内,三种养殖模式下水质中pH、氨氮、亚硝氮、硝氮的变化Fig.1Changes in pH,and levels of ammonia nitrogen,nitrite nitrogen and nitrate nitrogen in water in the three different culture modes throughout the entire rearing period
“养鱼先养水”。水质对水产养殖至关重要。近十几来,大量陆源氮、磷物质(农业施肥、喷药,生活和工业废水)的注入致水体富营养化,水质生产力骤减,水质恶化事件屡见不鲜[13-15],给灌溉、供水、生态观光等造成了诸多不利影响。在水产养殖中,除上述陆源污染外,自身投饵过多的残饵污染也是水质三氮、磷骤升,水体老化的重要原因[16]。养殖水体中氮、磷、pH过高往往会影响水生动物的产卵、孵化、脱壳、摄食、生长等,甚至大量死亡,造成巨大的经济损失[17-19]。

图2 在整个养殖周期内,三种养殖模式下水质中活性磷、总磷、化学耗氧量、叶绿素a的变化Fig.2Changes in levels of reactive phosphorus,total phosphorus,chemical oxygen demand,and chlorophyll a in water of the three different culture modes throughout the entire rearing period

表2 三种养殖模式下异育银鲫的产量、体质量和存活率Tab.2The yield,body weight and survival of allogyogenetics silver crucian carp Carassius auratus gibelio in three culture modes
本研究结果发现:模式C的pH在大部分时间显著高于模式A和B,但模式C的氨氮、亚硝氮、硝氮、活性磷、叶绿素a含量基本上维持在显著低于模式A和B的水平,特别是在养殖中期(7、8月份)。造成这一结果的原因可能是:高pH严重影响鱼类和饵料生物的存活和生长,模式C生物量减少,氨氮、亚氮含量等水质指标偏低。但也有研究认为,模式C的水质指标偏低与混养草鱼有一定的关系。草鱼的粪便较鲫和鳊含更多的益生菌(如枯草芽孢杆菌等),具备更好的分解残饵和有机碎屑,降低了亚硝氮和氨氮的净水效果[20]。也有部分养殖户反映,用养过草鱼的水质养凡纳滨对虾的效果明显好于常规水质,这可能与养过草鱼的水质中含有益生菌有关。

图3 三种不同养殖模式下鲫肝胰脏和血清中的POD和SOD酶活的变化Fig.3Changes in POD and SOD activities in serum and hepatopancreas of allogyogenetics silver crucian carp Carassius auratus gibelio under three culture modes
3.2 不同养殖模式下鲫存活、生长及免疫相关酶活变化
本试验中,模式A(508.5±26.5)g和模式C(516.5±35.0)g鲫的平均体质量分别显著高于模式B(473.0±31.5)g,这主要是因为模式B中的鳊与鲫产生了食物和空间的竞争关系。鲢鳙为上层鱼类,主要摄食浮游植物和浮游动物;草鱼为中上层鱼类,主要摄食水草和高等水生植物碎片,也喜摄食配合饲料;而鲫和鳊同属底层鱼类,以摄食配合饲料、昆虫幼虫、植物碎片、杂物碎屑等为主[21]。本实验的另一结果即模式B下的鳊平均体质量(682.5± 36.7)g(待发表)很好地验证了鲫和鳊的竞争关系。尽管草鱼和鲫也存在食物竞争的关系,但鉴于草鱼数量不及鳊空间位差异的关系,模式C的鲫平均体质量没有明显减轻。模式A存活率(95.14%)最高,模式B(90.54%)次之,模式C(86.28%)最低,主要原因可能是模式C中养殖前期的高pH(6月份pH 9.16,7月份pH 9.41)使部分鲫受影响。
三种模式下鲫免疫体质差异所致的应激病害死亡也可能是存活率差异的原因。鱼类生活在水中,易受水环境因子骤变而引发的多种生理应激反应[22],并常伴随着活性氧ROS(reactive oxygen species)的瞬间过量产生[23]。过量的ROS如超氧自由基(·O2-)、过氧化氢(H2O2)、羟自由基(·OH)、单线态氧分子(1O2)等除了维持自身的内环境稳态以及氧化杀伤入侵外,也会损害机体自身,如类脂中的不饱和脂肪酸发生过氧化反应破坏细胞膜的结构,降解DNA等[24]。而抗氧化酶系统(超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPX)等)在清除过量ROS,缓解自身损害中发挥重要的作用[25]。因此,抗氧化酶系统是水生动物应对水环境因子胁迫时的重要免疫预警系统,其酶活力水平往往代表着水生动物抵御外界环境刺激和病原侵袭的能力[26-29]。本文通过检测血液和肝胰脏中的POD和SOD酶活力变化发现:模式A血清和肝脏中的SOD均要显著高于模式B和C;血清中的POD亦保持很高的水平,与模式B无显著差异,但要显著高于模式C,暗示模式A的鲫抗逆水平要高于模式B和C,更易抵御环境刺激和病原侵袭和具更佳的养殖效果。
致谢:非常感谢东海水产研究所已毕业的研究生刘济源、郭雯斐、韩贻龙、王卓在水样采集、分析及酶活检测方面给予的帮助。
[1]段元慧,朱晓鸣,韩冬,等.异育银鲫幼鱼对饲料中维生素K需求的研究[J].水生生物学报,2013,37(1):8-15.
[2]崔小华.鲫鱼混养增产的技术关键[J].渔业致富指南, 2013,(3):36-37.
[3]秦蕾,张晓君,毕可然.一种新的异育银鲫病原:腐败希瓦氏菌[J].微生物学报,2012,52(5):558-565.
[4]夏飞,梁利国,谢骏.异育银鲫病原维氏气单胞菌的分离鉴定及药敏试验[J].淡水渔业,2012,42(5):22-26.
[5]章海鑫,胡鲲,阮记明,等.异育银鲫体内盐酸双氟沙星血浆蛋白结合率的变化[J].水生生物学报,2013,37(1): 62-69.
[6]Troell M,Joyce A,Chopin T,et al.Ecological engineering in aquaculture-potential for integrated multi-trophic aquaculture(IMTA)in marine offshore systems[J].Aquaculture,2009,297(1-4):1-9.
[7]冯翠梅,田相利,董双林,等.两种虾、贝、藻综合养殖模式的初步比较[J].中国海洋大学学报,2007,37(1):69-74.
[8]梁道栋,曹剑香,王成桂.土塘鱼虾混养高产高效养殖模式[J].中国水产,2009(7):32-33.
[9]王小冬,王伟良,董向全,等.不同放养和管理模式对三角帆蚌生长与养殖产量的影响[J].上海水产大学学报,2006, 15(3):315-320.
[10]赵广学,刘利平,李彦,等.凡纳滨对虾综合养殖与单养池塘的水质变化及产出效果比较[J].江苏农业科学, 2012,40(10):202-206.
[11]臧维玲.养鱼水质分析[M].北京:中国农业出版社, 1991:51-96.
[12]Bradford MM.Arapid and sensitive method for the quantification of micrograms quantities of proteins utilizing the principle ofprotein-dye building[J].Analytical Biochemistry,1976,72(1-2):248-254.
[13]刘丽萍,张秀敏,赵祥华.滇池水华综合控制对策探讨[J].上海环境科学,2002,21(12):745-747.
[14]Azanza R V,David L T,Borja R T,et al.An extensive Cochlodinium bloom along the western coast of Palawan, Philippines[J].Harmful Algae,2008,7(3):324-330.
[15]刘春兰.青岛浒苔暴发因素的探讨及对策[J].安徽农业科学,2013,41(4):1695-1698.
[16]祁真,杨京平,刘鹰.对虾池残饵、粪便及死虾腐解对养殖水质影响的模拟试验[J].水产科学,2004,23(11):5-8.
[17]Siikavuopio S I and Sæther B S.Effects of chronic nitrite exposure on growth in juvenile Atlantic cod,Gadus morhua[J].Aquaculture,2006,255(1-4):351-356.
[18]Pan L Q,Zhang L J and Liu H Y.Effects of salinity and pH on ion-transport enzyme activities,survival and growth ofLitopenaeus vannamei postlarvae[J].Aquaculture,2007,273(4):711-720.
[19]梁俊平,李健,李吉涛,等.氨氮对脊尾白虾幼虾和成虾的毒性试验[J].水产科学,2012,31(9):526-529.
[20]贺国龙,张恒,刘立鹤,等.饲喂枯草芽孢对草鱼粪便、养殖水体中芽孢数量和水质的影响[J].淡水渔业,2012, 42(2):35-39.
[21]王武.鱼类增养殖学[M].北京:中国农业出版社,2000: 17-22.
[22]Choi CY,An KWand An MI.Molecular characterization and mRNA expression of glutathione peroxidase and glutathione S-transferase during osmotic stress in olive flounder(Paralichthys olivaceus)[J].Comparative Biochemistryand Physiology-PartA,2008,149(3):330-337.
[23]Holmblad Tand Söderhäll K.Cell adhesion molecules and antioxidative enzymes in a crustacean,possible role in immunity[J].Aquaculture,1999,172(1-2):111-123.
[24]Xing J,Lin T T and Zhan W B.Variations of enzyme activities in the haemocytes of scallop Chlamys farreri after infection with the acute virus necrobiotic virus(AVNV)[J].Fish and Shellfish Immunology,2008,25(6): 847-852.
[25]Pipe R K,Porter C and Livingstone D R.Antioxidant enzymes associated with the blood cells and hemolymph of themusselMytilus edulis[J].Fish and Shellfish Immunology,1994,3(3):221-233.
[26]李晓英,董志国,阎斌伦,等.青蛤POD组织差异及温度骤升和窒息胁迫对青蛤POD的影响[J].海洋通报,2010, 29(5):521-525.
[27]庄平,王妤,章龙珍,等.盐度骤降对点篮子鱼存活率及肝脏抗氧化酶活性的影响[J].复旦学报,2011,50(3): 366-372.
[28]姜会民.氨氮胁迫对黄河鲤幼鱼肝胰脏、肾脏抗氧化性的影响[J].山东大学学报,2012,47(1):17-22.
[29]Lin T T,Xing J,Jiang J W,et al.β-glucan-stimulated activation of six enzymes in the haemocytes of the scallop Chlamysfarreri at different water temperatures[J]. Aquaculture,2011,315(3-4):213-221.
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

