石斑鱼杂交种“云龙斑”与亲本的表型数量性状判别分析
石斑鱼(Epinehelus)是我国重要的海水经济鱼类和优良种质资源,主要分布在东海和南海[1],2015年石斑鱼捕捞量达117 593 t、养殖量达100 006 t[2],在渔业经济中占有重要的地位。其中云纹石斑鱼(Epinehelus moara)适温范围(5~32 ℃)较广,生长速度较快,8月龄可达300~400 g,肉质极鲜美,是石斑鱼中的珍品;但苗种畸形率高、成活率低、病害多,神经坏死病毒和虹彩病毒常导致其苗种全部死亡[3]。鞍带石斑鱼(E. lanceolatus)分布在热带海域,适温范围为22~30 ℃,生长速度快,1龄鱼可生长到1.5~3.0 kg,2龄生长到5~6 kg[4],最大可以生长至约2.7 m、440 kg,是石斑鱼类中体型最大者,故也被称为“斑王”。借助石斑鱼精子冷冻保存技术能够突破种间生殖隔离的特点,田永胜等进行了两种鱼类的远缘杂交育种研究[5],目前已经在国内培育出具有生长快、成活率高、适温范围较广的杂交后代“云龙斑”[6],近两年已经推广到福建、海南和日本等地进行养殖,取得了一定的经济成效。但作为人工培育的养殖新品种,对其表型生物学性状的特征还未有研究。
表型生物学性状是进行鱼类分类、种质检测、遗传变异分析的主要指标,生物学多元统计分析方法是进行表型性状分析和判别的主要手段。目前利用方差分析、相关分析、聚类分析、判别分析和主成分分析等方法对新疆土著鱼类进行了数值分类[7],对中国沿海花鲈群体的形态差异[8]、红鳍东方鲀(Takifugu rubripes)3个不同群体的形态差异及雌、雄个体的形态特征比较[9-10]、星突江鲽和石鲽正反杂交种的形态变异[11]等进行了研究。近年来利用RAPD、SSR分子标记分别对5种石斑鱼的遗传差异、4种石斑鱼遗传多样性和亲缘关系、斜带石斑鱼不同地理群体的遗传变异等进行了研究[12-14]。但是对于石斑鱼表型性状的变异研究报道较少,王燕等对两种杂交石斑鱼及亲本的形态差异进行了分析[15],郭明兰等对云纹石斑和褐石斑的解剖形态进行了比较分析[16],但对云纹石斑鱼和鞍带石斑鱼及杂交后代的形态性状比较及变异方面的研究还未见报道。
本文利用生物学多元统计方法,通过对云纹石斑鱼和鞍带石斑鱼及杂交后代“云龙斑”表型数量性状进行多重比较、杂交系数比较、判别分析和主成分分析,首次为两种石斑鱼及远缘杂交后代“云龙斑”的种质鉴别及遗传变异分析提出了主要的判别性状和函数关系,为石斑鱼杂交后代的种质鉴定提供技术依据。
1 材料与方法1.1 材料来源和表型数量性状测定从莱州明波水产有限公司培育的200尾云纹石斑群体中抽取29尾个体,体质量为1 050~2 110 g,平均为(1 534.82±267.92)g,全长为41.4~52.2 cm, 平均为(46.96±2.66)cm。从三亚陵水收集池塘养殖的鞍带石斑鱼30尾,体质量为807~1 553 g,平均为(1067.9±173.91)g,全长为34~45.8 cm,平均为(39.86±2.10)g;“云龙斑”为2014年和2015年利用鞍带石斑鱼冷冻精子与云纹石斑鱼杂交培育家系后代群体5万多尾,筛选养殖3 000多尾,从中抽取29尾,体质量为36.8~633.8 g,平均为(167.81±195.51)g, 全长为13.4~33.5 cm,平均为(18.83±7.26)cm。对以上抽取样本的体质量、全长、体长、头长、尾柄长、尾柄高、头长、眼间距进行测量,同时对背鳍硬鳍条、背鳍软鳍条、胸鳍条、腹鳍条、臀鳍硬鳍条、臀鳍软鳍条、尾鳍条数进行计量。此外利用Excel统计表计算可量性状的比例值(表 1)。
|
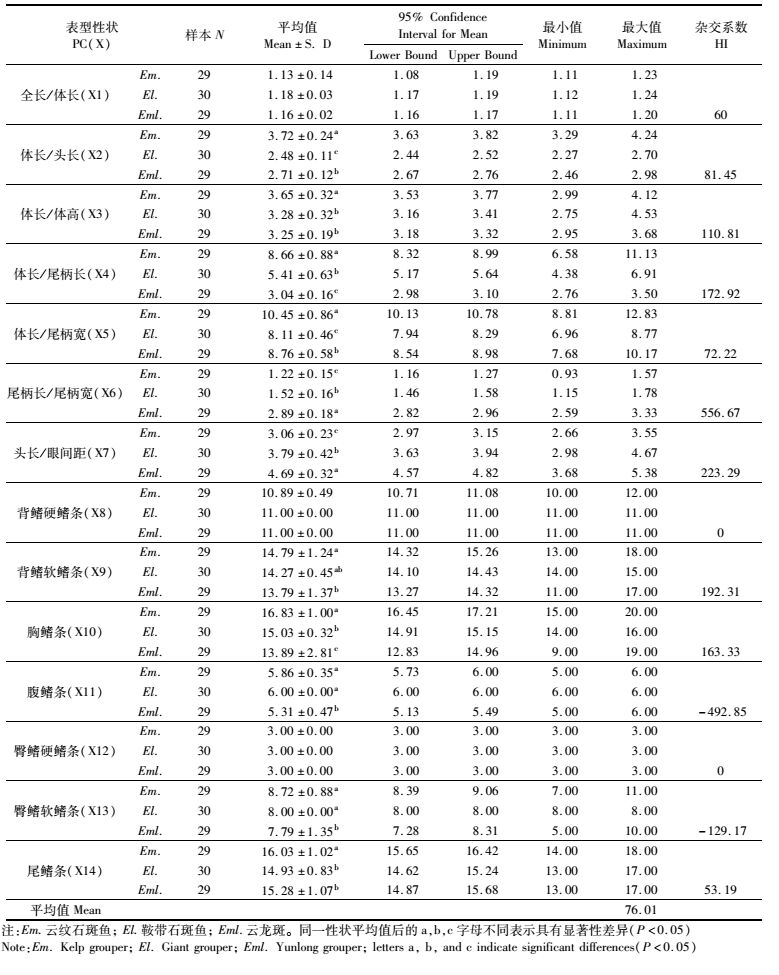
表 1 “云龙斑”与云纹石斑、鞍带石斑鱼表型性状及杂交系数对比分析Tab.1 Comparative analysis of phenotypic characters and hybridization index of "Yunlong grouper", Kelp grouper E.moara and Giant grouper E.lanceolatus |
将全长、体长、头长、尾柄长、尾柄高、头长、眼间距7个可量性状换算成比例性状,与鳍条数等7个可数性状一起,按照公式(1)计算杂交种的杂种指数HI(hybrid index):
 (1)
(1)
式中:Hi为杂交种平均值; Mi1为母本平均值; Mi2为父本平均值, 45<HI<55属中间性状, HI<45为偏母本性状, HI>55为偏父本性状, HI>100或HI<0为超亲偏离性状[11]。
1.3 云纹石斑鱼、鞍带石斑鱼及杂交后代性状的判别分析及主成分分析利用SPSS统计分析软件中判别分析(Discriminant analysis)的逐步判别分析法(Stepwise method)对云纹石斑鱼、鞍带石斑鱼及杂交后代群体的14个表型性状值(表 1)进行分析。拟合出3个群体的生物学特征典型判别函数:
 (2)
(2)
 (3)
(3)
式中:F为典型判别函数;Y为分类判别函数;a为典型判别系数;b为相关系数;x为性状变量。分别计算判别准确率,并绘制3个种群二维分类图[17]。
从14个生物学性状中剔除无显著性差异的性状X12(臀鳍硬鳍条),利用萃取法(Extraction Method)对其他13个性状变量进行主成分分析(Principal component analysis),分析3个生物学群体性状的主成分及贡献率,并拟合出主成分线性函数
 (4)
(4)
式中:P为主成分;c为主成分相关系数;x为性状变量。利用前3个主成分绘制出3个生物学群体的三维空间分布图[17]。
1.4 数据处理利用Excel统计软件建立测量数据库并对可量性状值进行校正,计算出比例值。利用SPSS 16.0统计软件对数据进行单因素方差分析(One-way ANOVA),多重比较(Student-Newman-Keuls)、判别分析和主成分分析,P<0.05表示具有显著性差异,P>0.05表示差异不显著,表型性状值为平均值±标准差。
2 结果2.1 “云龙斑”与云纹石斑鱼、鞍带石斑鱼表型性状对比分析对“云龙斑”与其母本云纹石斑鱼和父本鞍带石斑鱼14个可量和可数表型性状对比分析结果显示,云纹石斑鱼与鞍带石斑鱼在全长/体长、背鳍硬鳍条和软鳍条、腹鳍条、臀鳍硬鳍条和软鳍条6个性状上无显著性差异(P>0.05),在其他8个性状上具有显著性差异(P<0.05),云纹石斑鱼的胸鳍条(16)和尾鳍条(16)多于鞍带石斑鱼(15,15),云纹石斑鱼可量性状中除全长/体长、尾柄长/尾柄宽、头长/眼间距3个性状小于鞍带石斑鱼之外,其他可量性状比例都大于鞍带石斑鱼。
“云龙斑”与云纹石斑鱼在全长/体长、背鳍硬鳍条(11)、臀鳍硬鳍条(3)3个性状上无显著性差异(P>0.05),在其他11个性状上都有显著性差异(P<0.05)。云纹石斑鱼各鳍条数都多于“云龙斑”,“云龙斑”可量性状除尾柄长/尾柄宽、头长/眼间距大于云纹石斑鱼,全长/体长无显著差异,其他可量性状都小于云纹石斑鱼。“云龙斑”与鞍带石斑鱼在全长/体长、体长/体高、背鳍硬鳍条和软鳍条、臀鳍硬鳍条、尾鳍条6个性状上无显著性差异(P>0.05),在其他8个性状上具有显著性差异(P<0.05)。“云龙斑”的尾柄长/尾柄宽、头长/眼间距显著的大于鞍带石斑鱼(P<0.05),胸鳍条数显著少于鞍带石斑鱼,尾鳍条数显著多于鞍带石斑鱼(P<0.05, 表 1)。
综合以上性状,“云龙斑”与母本云纹石斑鱼在表型上的相似率达到27.27%,与父本鞍带石斑鱼的相似率达到54.54%。云纹石斑鱼与鞍带石斑鱼的相似率为54.54%。
2.2 杂交系数利用14个可量性状和可数性状的分析结果显示,除背鳍硬鳍条、腹鳍、臀鳍硬鳍条、臀鳍软鳍条数4个可数性状的杂交系数小于45,为偏母本性状,其他10个性状的杂交系数均大于55,为偏父本性状。其中体长/体高、体长/尾柄长、尾柄长/尾柄宽、头长/眼间距、背鳍软鳍条、胸鳍、腹鳍、臀鳍软鳍条8个性状的杂交系数均大于100或小于0,呈现出超亲性状。14个性状的平均杂交系数为76.01,说明杂交后代“云龙斑”的表型数量性状特征偏向于父本。
2.3 亲本及杂交后代“云龙斑”的判别分析通过逐步判别分析剔除无显著差异(P>0.05)的性状,5步筛选出具有极显著性差异(P<0.01)的5个生物学性状:尾柄长/尾柄宽(X6)、体长/头长(X2)、体长/尾柄长(X4)、体长/尾柄宽(X5)、腹鳍(X11)可以达到对3个群体进行有效的判别分析(表 2)。

|
表 2 3个鱼类群体14个性状的逐步判别Wilks’ Lambda值Tab.2 Wilks' Lambda values of Stepwise Discriminant analysis of 14 traits in three fish groups |
依据逐步分析筛选出的极显著性状和典型判别系数拟合出2个典型判别函数:
 (5)
(5)
 (6)
(6)
判别函数F1和F2的贡献率分别达到79.4%和20.6%(表 3),将3个鱼类群体的x2、x4、x5、x6、x11 5个可量和可数性状值带入以上两个典型判别函数计算每个群体的二维坐标,绘制出了3个鱼类群体在二维平面上的分布图(图 1),将云纹石斑鱼(group1)、鞍带石斑鱼(group2)和云龙斑(group3)在二维空间明显的区分为3个不能重叠的生物学群体。

|
表 3 典型判别函数(F1和F2)的特征值和贡献率Tab.3 Eigenvalues and variance canonical discriminant function |

|
图 1 云纹石斑鱼(group1)、鞍带石斑鱼(group2)和云龙斑(group3)二维空间分布图Fig. 1 Two-dimensional spatial distribution of Kelp grouper(group1), Giant grouper(group2) and Yunlong grouper(group3)Function1, Function2分别为典型判别函数F1和F2 Function1, Function2 are the canonical discriminant function (F1 and F2), respectively |
同时依据分类函数相关系数及具极显著差异的生物学性状,拟合出3个生物学群体的分类判别函数:
 (7)
(7)
 (8)
(8)
 (9)
(9)
利用以上分类判别函数对现有群体的测量性状变量进行回代分析,比较计算出以上函数值及判别准确率,判别准确率平均为98.85%。
2.4 3个鱼类群体性状的主成分分析依据13个生物学性状变量的方差变异率分析结果可以看出,前3个主成分的总方差积累贡献率达到62.891%,前7个主成分的总方差积累贡献率达到88.617%(表 4)。从而列出前7个主成分与13个性状变量的相关系数(表 5),拟合出前3个主成分与性状变量的线性函数关系:

|
表 4 主成分总方差变异率分析Tab.4 Total variance explained of principal component analysis |

|
表 5 前7个主成分相对于13个性状变量的线性组合系数矩阵Tab.5 Component matrix of principal component analysis by 13 character variables |
P1=0.932x4-0.881x7+0.825x2-0.788x6+0.707x5+0.684x10+0.621x3+0.459x11+0.484x9+0.542x13-0.192x1-0.180x8+0.394x14
P2=-0.712x11+0.539x5+0.441x6+0.409x3+0.391x14+0.384x2 -0.286x10+0.248x7-0.196x1+0.175x13 -0.172x9-0.075x4 -0.021x8
P3=0.667x9+0.596x13+0.391x8+0.229x10+0.195x6-0.190x4+0.186x7+0.161x14 -0.142x3+0.139x1-0.130x2 -0.069x5 -0.066x11
第一主成分主要解释体长/尾柄长(X4)、头长/眼间距(X7)、体长/头长(X2)、尾柄长/尾柄宽(X6)、体长/尾柄宽(X5)5个性状的贡献率。第二主成分主要解释腹鳍条(X11)的贡献率。第三主成分主要解释背鳍软鳍条(X9)的贡献率。
根据前3个主成分得分,在3个主成分轴上绘制出3个生物学群体的三维空间分布图(图 2),可见利用前3个主成分基本上可以将3个群体进行有效分类。

|
图 2 云纹石斑鱼◇、鞍带石斑鱼〇和云龙斑△在3个主成分上的三维空间分布图Fig. 2 Three-dimensional spatial distribution of Kelp grouper◇, Giant grouper〇 and Yunlong grouper△Factor 1, Factor 2和Factor 3分别为主成分1、2和3 Factor 1, Factor 2 and Factor 3 are the principal component 1, 2 and 3, respectively |
遗传性状是指生物体能世代相传的一切形态特征、生理特性、代谢类型、行为本能等的通称,是由遗传基因决定的。表型性状不仅由遗传因素决定,而且同时受到环境因素影响,通常以连续变动的数量性状形式表现出来[18]。表型性状可以直观的、利用简单的测量方式大量获得,可为物种分类、遗传变异及种质鉴定提供大量的性状数据。从20世纪末开始, 遗传性状分析手段得到了迅速的发展,如AFLP、RAPD、SSR、SNP和全基因组测序技术,但是表型数量性状的研究依然是遗传育种、种质鉴别的主要手段。在牙鲆新品种鉴定中,利用SSR标记和表型数量性状相结合对同源的牙鲆卵裂雌核发育系、减数雌核发育系和近交系的遗传变异进行分析,为3个纯系的的遗传进展提供了证据[18]。对牙鲆新品种“鲆优1号”与亲本的遗传变异进行了分析,多重比较结果显示“鲆优1号”与母本无显著差异性状占50%,与父本无显著性差异性状占33.3%[19]。星突江鲽(Platichthys stellatus)与石鲽(Kareius bicoloratus)的正反杂交种在眼睛位置、鳞片和鳍的形态特征上更倾向于星突江鲽, 而侧线、可数、可量性状则更多地遗传了母本的形态特征[11]。翘嘴红鲌(♀)和团头鲂(♂)杂交F1的可数性状介于父母本之间[20]。本研究通过14个表型数量性状的多重比较显示,“云龙斑”与母本云纹石斑鱼相似率达到27.27%,与父本鞍带石斑鱼相似率达到54.54%, 可见鱼类不同品种之间的杂交后代性状表现因品种而异。但对于“云龙斑”遗传性状及杂交优势性状的分析, 还需要进一步的研究。利用杂交系数可以对后代性状变异与亲本亲缘关系进行评价。星突江鲽和石鲽正反杂交可数性状的杂种指数分别为20.73和20.76, 可量性状的杂种指数分别为27.16和26.47,杂交后代的性状都偏向于母本[11]。云纹石斑鱼与鞍带石斑鱼杂交后代的14个表型性状的平均杂交系数为76.01,杂交后代“云龙斑”的表型性状偏向于父本,验证了性状多重比较的结果。利用杂交系数、近交系数和连锁不平衡分析等对18个切喉鳟(Oncorhynchus clarki)群体和引进的虹鳟(O. mykiss)的渐近杂交效应进行了研究,发现分布于British Columbia的切喉鳟存在基因灭绝的危险[21]。
判别分析(Discriminant analysis)是进行种群分类和鉴别的多元统计分析方法之一,通过大量的种群性状的分析和筛选,可以建立以主要性状为主的判别函数,为鱼类种质的鉴定提供可靠的分析依据。该方法已经广泛地应用于花鲈[8]、红鳍东方鲀[9]、Barilius bendelisis[22]等鱼类种群分类性状变异分析,以及不同鱼类品种及杂交后代形态比较分析[10-11, 23]。利用10个贡献率较大的性状参数建立了大菱鲆(Scophthalmus maximus)、星斑川鲽(Platichthys stellatus)和杂交后代的判别函数,判别准确率达到98.9%[23]。利用筛选的12个SSR标记位点对珊瑚礁鱼(Chaetodon trifasciatus)的6个群体进行判别分析,判别率达到95%[24]。本研究利用14个数量性状对云纹石斑鱼、鞍带石斑鱼及杂交后代“云龙斑”进行判别分析,建立了以尾柄长/尾柄宽、体长/头长、体长/尾柄长、体长/尾柄宽、腹鳍条数5个贡献率显著性状的判别函数,判别率达到98.85%;可以将亲本和杂交后代在二维空间中明显的区分,为杂交后代“云龙斑”的种质鉴定提供了技术依据。
主成分分析(Principal Component Analysis)是通过降维处理,将多个相互关联的变量转化为少数几个线性不相关的综合变量的统计方法[17],可以综合反映原来较多的信息,从大量数据中提取贡献率最大的信息。主成分分析主要应用于鱼类种群的演变及养殖新品种性状的分析。BOURRET等利用大西洋鲑(Salmo salar)基因组中的6 176个SNP位点对分布在欧洲和北美的38个地理群体的自然分布和潜在的适应性进行了主成分分析,清晰地区分了北美群体、欧洲的3个基因型群体,第一主成分的贡献率为38.4%[25]。GARRETT等利用QST-FST多元统计方法对分布在苏比略湖盆地的3个溪红点鲑(Salvelinus fontinalis)的遗传和表型变异进行分析,发现了种群形态的历史变异,归咎于长期的自然和人工选择及遗传漂变[26]。谷伟等利用11个可量、可数性状经采用多元统计法对美国虹鳟、美国金鳟、芬兰虹鳟及渤海虹鳟4个品系的形态变异进行了分析,得出美国虹鳟和美国金鳟形态最相近, 其次与芬兰虹鳟相似[27]。本研究利用13个生物学性状对云纹石斑鱼、鞍带石斑鱼及杂交后代“云龙斑”的表型数量性状进行主成分分析,发现体长/尾柄长、头长/眼间距、体长/头长、尾柄长/尾柄宽、体长/尾柄宽、腹鳍条、背鳍软鳍条7个性状对于区分杂交后代及亲本具有重要作用,进一步论证了判别分析的结果。前3个主成分的贡献率达到62.89%,能够成功地区分3个生物学群体,为云纹石斑鱼、鞍带石斑鱼及杂交后代“云龙斑”的种质鉴定提供了丰富的理论和技术基础。
综上所述,通过对云纹石斑鱼、鞍带石斑鱼及杂交后代“云龙斑”14个表型数量性状的多重比较、杂交系数比较、判别分析和主成分分析,筛选出了能够鉴别以上3个生物群体的有效表型数量性状,建立了鉴定杂交后代“云龙斑”和亲本的判别函数和主成分函数关系,为以上3个生物群体的鉴别提供了有力的科学依据。
| [1] |
孟庆闻, 苏锦祥, 缪学祖. 鱼类分类学[M]. 北京: 中国农业出版社, 1995: 606-622. MENG Q W, SU J X, MIAO X Z. Systematics of fishes[M]. Beijing: China Agriculture Press, 1995: 606-622. |
| [2] |
农业部渔业渔政管理局. 中国渔业统计年鉴2016[M]. 北京: 中国农业出版社, 2016: 21-86. Prepared by the Fishery Administration Bureau of the Ministry of Agriculture. China fishery statistical yearbook 2016[M]. Beijing: China Agriculture Press, 2016: 21-86. |
| [3] |
宋振鑫, 陈超, 翟介明, 等. 云纹石斑鱼生物学特性及人工繁育技术研究进展[J]. 渔业信息与战略, 2012, 27(1): 47–53. SONG Z X, CHEN C, ZHAI J M, et al. Biological characteristics and progress of artificial breeding technique for Kelp bass, Epinephelus moara[J]. Fishery Information & Strategy, 2012, 27(1): 47–53. |
| [4] |
杨洪志, 梁荣峰. 鞍带石斑鱼Epinephelus lanceolatus (Bloch)繁殖生物学的初步研究[J]. 现代渔业信息, 2002, 17(7): 20–21. YANG H Z, LIANG R F. Primary study on reproduction biology of Epinephelus lanceolatus (Bloch)[J]. Modern Fisheries Information, 2002, 17(7): 20–21. |
| [5] | TIAN Y S, JIANG J, WANG N, et al. Sperm of the giant grouper:cryopreservation, physiological and morphological analysis and application in hybridizations with red-spotted grouper[J]. Journal of Reproduction and Development, 2015, 61(4): 333–339.DOI:10.1262/jrd.2014-087 |
| [6] |
中国水产养殖网. 云龙斑人工培育成功[N/OL]. 中国渔业报, 2016-07-25. http://www.shuichan.cc/news_view-289865.html. China Aquaculture Network. Yunlong grouper artificial cultivation success[N/OL]. China Fisheries Daily, 2016-07-25. http://www.shuichan.cc/news_view-289865.html. |
| [7] |
田永胜, 王国英, 潘育英. 新疆土著鱼类的数值分类[J]. 八一农学院学报, 1994, 17(1): 86–93. TIAN Y S, WANG G Y, PAN Y Y. Numerical classification studies on native fishes of Xingjiang[J]. Journal of August lst Agricultural College, 1994, 17(1): 86–93. |
| [8] |
侯吉伦, 赵雅贤, 任建功, 等. 中国沿海6个花鲈群体的形态差异分析[J]. 海洋渔业, 2016, 38(5): 459–467. HOU J L, ZHAO Y X, REN J G, et al. Morphological variations of six spotted sea bass (Lateolabrax maculatus) geographical populations along China coast[J]. Marine Fisheries, 2016, 38(5): 459–467. |
| [9] |
马爱军, 王新安, 孙志宾, 等. 红鳍东方鲀(Takifugu rubripes)三个不同群体的形态差异分析[J]. 海洋与湖沼, 2016, 47(1): 166–172. MA A J, WANG X A, SUN Z B, et al. Morphological variations among three different populations of Takifugu rubripes[J].Oceanologia et Limnologia Sinica, 2016, 47(1): 166–172. |
| [10] |
岳亮, 王新安, 马爱军, 等. 红鳍东方鲀(Takifugu rubripes)雌、雄个体的形态特征比较[J]. 渔业科学进展, 2016, 37(1): 30–35.DOI:10.11758/yykxjz.20141215001 YUE L, WANG X A, MA A J, et al. Comparison of the morphological traits between male and female individuals of Takifugu rubripes[J]. Progress in Fishery Sciences, 2016, 37(1): 30–35. DOI:10.11758/yykxjz.20141215001 |
| [11] |
曹栋正, 陈四清, 严俊丽, 等. 星突江鲽和石鲽正反杂交种的形态变异分析[J]. 中国水产科学, 2016, 23(4): 871–881. CAO D Z, CHEN S Q, YAN J L, et al. Morphological variations analysis of reciprocal hybrids from Platichthys stellatus and Kareius bicoloratus[J]. Journal of Fishery Sciences of China, 2016, 23(4): 871–881. |
| [12] |
区又君, 吴勇, 李加儿, 等. 5种石斑鱼遗传差异的RAPD分析[J]. 南方水产, 2008, 4(2): 56–62. OU Y J, WU Y, LI J E, et al. RAPD analysis of genetic difference among five species of grouper[J]. South China Fisheries Science, 2008, 4(2): 56–62. |
| [13] |
尹绍武, 黄海, 廖经球, 等. 4种石斑鱼的分子遗传多样性和亲缘关系的RAPD分析[J]. 海洋学报, 2006, 28(6): 119–126. YIN S W, HUANG H, LIAO J Q, et al. RAPD analysis of molecular genetic diversity and genetic relationship of four grouper species[J]. Acta Oceanologica Sinica, 2006, 28(6): 119–126. |
| [14] |
王家祺, 郭丰, 丁少雄, 等. 斜带石斑鱼不同地理群体遗传变异的微卫星分析[J]. 海洋科学, 2009, 33(11): 60–64. WANG J Q, GUO F, DING S X, et al. Genetic diversity of different geographical stocks of Epinephelus coioides by microsatellite DNA[J]. Marine Sciences, 2009, 33(11): 60–64. |
| [15] |
王燕, 张勇, 张海发, 等. 两种杂交石斑鱼及其亲本的形态差异分析[J]. 水产学报, 2014, 38(6): 778–785. WANG Y, ZHANG Y, ZHANG H F, et al. Comparison of morphology between two kinds of hybrid groupers and their parents[J].Journal of Fisheries of China, 2014, 38(6): 778–785. |
| [16] |
郭明兰, 苏永全, 陈晓峰, 等. 云纹石斑鱼与褐石斑鱼形态比较研究[J]. 海洋学报, 2008, 30(6): 106–114. GUO M L, SU Y Q, CHEN X F, et al. Comparative studies on morphology of Epinephelus moara and E. bruneus[J]. Acta Oceanologica Sinica, 2008, 30(6): 106–114. |
| [17] |
宇传华. SPSS与统计分析[M]. 北京: 电子工业出版社, 2007: 145-267. YU C H. SPSS and statistical analysis[M]. Beijing: Publishing House of Electronics Industry, 2007: 145-267. |
| [18] |
田永胜, 段会敏, 李祥孔, 等. 牙鲆三个同源纯系的生长和遗传性状比较[J]. 中国水产科学, 2017, 24(1): 11–21. TIAN Y S, DUAN H M, LI X K, et al. Growth and genetic analysis among three homologous inbred strains of Paralichthys olivaceus[J]. Journal of Fishery Sciences of China, 2017, 24(1): 11–21. |
| [19] |
田永胜, 齐文山, 姜静, 等. "鲆优1号"牙鲆和亲本群体的表型及遗传性状变异分析[J]. 海洋学报, 2014, 36(6): 75–86. TIAN Y S, QI W S, JIANG J, et al. Analysis of phenotype and genetic variation of on "Flounder No.1" Paralichthys olivaceus and their parental populations[J]. Acta Oceanologica Sinica, 2014, 36(6): 75–86. |
| [20] |
顾志敏, 贾永义, 叶金云, 等. 翘嘴红鲌(♀)×团头鲂(♂)杂种F1的形态特征及遗传分析[J]. 水产学报, 2008, 32(4): 533–544. GU Z M, JIA Y Y, YE J Y, et al. Studies on morphological characteristics and genetic analysis of the hybrid F1, Erythroculter ilishaeformis♂×Megalobrama amblycephal♀[J]. Journal of Fisheries of China, 2008, 32(4): 533–544. |
| [21] | RUBIDGE E M, TAYLOR E B. Hybrid zone structure and the potential role of selection in hybridizing populations of native westslope cutthroat trout (Oncorhynchus clarki lewisi) and introduced rainbow trout (O. mykiss)[J]. Molecular Ecology, 2004, 13(12): 3735–3749. DOI:10.1111/j.1365-294X.2004.02355.x |
| [22] | MIR J I, SAXENA N, PATIYAL R S, et al. Phenotypic differentiation of Barilius bendelisis (Cypriniformes:Cyprinidae) in four rivers from Central Indian Himalaya[J]. Revista de Biología Tropical, 2015, 63(1): 165–173. DOI:10.15517/rbt.v63i1 |
| [23] |
马海涛, 韩承慧, 滕照军, 等. 大菱鲆(Scophthalmus maximus)、星斑川鲽(Platichthys stellatus)及其杂交种的形态学分析[J]. 海洋与湖沼, 2014, 45(6): 1380–1386. MA H T, HAN C H, TENG Z J, et al. Morphological analysis to Scophthalmus maximus, Platichthys stellatus and their hybrid[J].Oceanologia et Limnologia Sinica, 2014, 45(6): 1380–1386. |
| [24] | MONTANARI S R, Van HERWERDEN L, PRATCHETT M S, et al. Reef fish hybridization:lessons learnt from butterflyfishes (genus Chaetodon)[J]. Ecology and Evolution, 2012, 2(2): 310–328. DOI:10.1002/ece3.83 |
| [25] | BOURRET V, KENT M P, PRIMMER C R, et al. SNP-array reveals genome-wide patterns of geographical and potential adaptive divergence across the natural range of Atlantic salmon (Salmo salar)[J]. Molecular Ecology, 2013, 22(3): 532–551.DOI:10.1111/mec.12003 |
| [26] | MCKINNNEY G J, VARIAN A, SCARDINA J, et al. Gene-tic and morphological divergence in three strains of brook trout Salvelinus fontinalis commonly stocked in Lake Superior[J]. PLoS One, 2014, 9(12): e113809. DOI:10.1371/journal.pone.0113809 |
| [27] |
谷伟, 高会江, 王炳谦. 虹鳟4个品系的形态变异及判别分析[J]. 安徽农业大学学报, 2009, 36(2): 241–246. GU W, GAO H J, WANG B Q. Morphous and discriminatory analysis on the four strains rainbow trout (Oncorhynchus mykiss)[J].Journal of Anhui Agricultural University, 2009, 36(2): 241–246. |
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

