论文:鲤春病毒血症病毒截短糖蛋白的原核表达及抗体制备
鲤春病毒血症病毒截短糖蛋白的原核表达及抗体制备
林婧楠,赵景壮,徐黎明,刘 淼,任广明,卢彤岩
(1.上海海洋大学水产科学国家级实验教学示范中心,上海 201306;2.中国水产科学研究院 黑龙江水产研究所,哈尔滨 150070;3.上海海洋大学国家水生动物病原库,上海 201306)
鲤春病毒血症(spring virernia of carp,SVC)是当前国际动物卫生组织(Office International Des Epizooties,OIE)必报的重要疫病之一,也是2008年我国颁布的动物疫病名录中的一类动物疫病[1]。该病常在春季爆发,能够引起鲤科鱼类大量死亡。该病最开始在中世纪欧洲大部分地区流行,我国首次报道是刘荭等[2]在2003年从无临床症状的观赏鱼中分离出鲤春病毒血症病毒(spring virernia of carp virus,SVCV)。目前该病已严重威胁我国淡水养殖以及观赏鱼的出口问题,因此建立良好的检测方法尤为重要。
SVCV是一种高传染性、高致病性的弹状病毒[3]。从3′端到5′端编码5种蛋白分别为核蛋白(Nuclear protein,N)、磷蛋白(Phosphoprotein,P)、基质蛋白(Matrixprotein,M)、糖蛋白(Glycoprotein,G)和RNA聚合酶(RNA polymerase,L)[4]。根据糖蛋白的核酸序列,可将SVCV分成Ia、Ib、Ic和Id 4个基因型[5],而目前我国SVCV分离株的基因型均为Ia[6,7]。
G蛋白是位于病毒粒子上长钉状的突起,因其含有抗原决定簇,在免疫应答方面起到决定性的作用[8,9]。目前,国内外大部分关于SVCV单克隆抗体和多克隆抗体的制备多基于G蛋白。本研究以SVCV黑龙江分离株shlj1为研究对象,通过对SVCV shlj1毒株G蛋白氨基酸序列进行跨膜区域及B细胞抗原表位预测,选取富含抗原表位的G蛋白基因片段进行体外原核表达及纯化,以制备抗血清,建立SVCV的免疫学检测方法,为SVC疫病监测提供技术保障。
1 材料与方法
1.1 实验材料
毒株:课题组在东北地区养殖鲤流行病调查中分离保存5株毒株(黑龙江省:SVCV-shlj1、SVCV-shlj2、SVCV-shlj3,辽宁省:SVCV-ln201801、SVCV-ln201802),其中SVCV-shlj1病毒滴度为106.28TCID50/mL[10];细胞株:黑头呆鱼上皮细胞(Epithelioma papulosum cyprini,EPC)由中国水产科学研究院长江水产研究所鱼类病害防治教研室曾令兵教授惠赠;载体:pET-32a表达载体由本实验室保存。
限制性内切酶、rTaq酶、Trizol、DL2000 DNA Marker、大肠杆菌(E.coli)DH5α、BL21(DE3)感受态细胞、pMD18-T克隆载体、PrimeScriptTMOne Step RT-PCR Kit Ver2.0试剂盒购自宝生物工程(大连)有限公司,T4连接酶购自NEB公司,DNA胶回收试剂盒、质粒DNA提取试剂盒购自OMEGA公司,HRP标记羊抗鼠IgG、FITC标记羊抗鼠IgG购自Abcam公司,异丙基硫代-β-D-半乳糖苷(Isopropyl-beta-D-thiogalactopyranoside,IPTG)购自Sigma Aldrich公司。
1.2 方法
1.2.1 引物设计
根据本实验室分离保存的SVCV分离株shlj1的基因序列(NCBI登录号:KX911973),应用TMHMM Server在线分析软件及DNAStar 6.0(Protean)软件对G全长蛋白的跨膜区域及抗原指数进行分析预测,筛选出G截短蛋白的区域,在其上下游分别插入BamH I(GGATCC)或者SalI(GTCGAC)酶切位点,利用Primer Premier 5.0软件设计用于扩增SVCV G截短蛋白基因的引物,根据其结果,上游引物为5′ GGATCCTGGATCGATCATGAATTCAATGGGG 3′,下游引物为5′ GTCGACAGTATATTCTACCACATTTTCC 3′,引物由长春库美生物公司合成。
1.2.2 目的片段的扩增及重组质粒的构建
采用Trizol法提取SVCV shlj1毒株总RNA,以其为模板,利用TaKaRa公司的One Step RT-PCR Kit试剂盒扩增目的基因。将获取的目的基因胶回收,克隆至pMD18-T simple载体中,通过菌液PCR鉴定,鉴定为阳性的单菌落经测序确认无误,提取质粒命名为:pMD18-T-G。将pMD18-T-G质粒和pET-32a载体分别利用BamH I、SalI进行双酶切,酶切产物胶回收后,利用T4连接酶,16 ℃连接过夜。将连接产物转入DH5α感受态中,涂于含有氨苄青霉素抗性的LB平板中培养,挑取单菌落,进行菌液PCR鉴定。鉴定为阳性的菌落扩大培养后提取质粒进行酶切鉴定,最终鉴定正确的质粒命名为:pET-32a-G。
1.2.3 G蛋白的诱导表达
将pET-32a-G重组质粒转入Rosetta表达菌株中。由于商业化的Rosetta表达菌株已经含有一个增强外源蛋白表达的质粒,因此本研究利用PCR方法对重组菌进行鉴定。挑取阳性的重组菌,接种于含氨苄青霉素的LB液体培养基中扩大培养,培养至OD600值为0.5左右,向其中添加终浓度为0.25 mmol/L的IPTG,分别在未诱导前,以及诱导后2-6 h,每隔1 h,取2 mL菌液,离心(1 min,10 000 r/min)。用PBS重悬菌体后超声破碎,留取破碎后的全菌、菌液上清和菌液沉淀,并向其中加入蛋白上样缓冲液后煮沸,利用12% SDS-PAGE电泳对重组蛋白诱导表达情况进行分析。
1.2.4 重组G蛋白的纯化
收集诱导后(37 ℃,6 h)的阳性重组菌(500 mL),采用蛋白变性复性的方法对超声破碎的菌体进行纯化[11],经变性液(含有8 mol/L尿素)变性12 h及复性液(含有2 mol/L尿素)复性8 h处理后,将复性后的蛋白样离心,上清放置透析袋中,置于PBS缓冲液中透析36 h,每12 h换液。利用超微量核酸蛋白测定仪(ScanDrop200,德国耶拿)测定纯化后蛋白的浓度,并利用12% SDS-PAGE电泳对纯化后的蛋白进行分析。将纯化后蛋白用细菌过滤器过滤后,分装在无菌的EP管中,置于-80 ℃冰箱保存。
1.2.5 试验动物的免疫及血清收集
将纯化后的重组G蛋白作为免疫原,选取6-8周龄、体重在20 g左右的雌性Balb/c小鼠,采用背部皮下多点注射法进行免疫。G蛋白的免疫剂量为1 mg/kg,首免采用等体积的G蛋白与完全弗氏佐剂乳化免疫小鼠,10 d、20 d后进行第2、3次免疫,采用等体积的G蛋白与不完全弗氏佐剂乳化免疫小鼠。同时设立对照组,用PBS缓冲溶液代替纯化后G蛋白与乳化剂乳化免疫。第三次免疫结束10 d后,眼球采血,将血液置于37 ℃静置1 h左右,3 000 r/min离心10 min分离出清亮的血清,分装于无菌的EP管中,置于-80 ℃冰箱保存。
1.2.6 抗体效价的分析
采用ELISA对抗体的效价进行分析,设置空白组(PBS稀释液)、阴性对照组(未免疫的小鼠血清)和实验组(鼠1、鼠2)。以纯化后的G蛋白作为酶标试剂板的包被物(终浓度为0.025 mg/mL),每孔100 μL,4 ℃包被过夜;以制备的鼠抗血清为一抗,设置一定的稀释倍数(1∶10 000、20 000、40 000、80 000、160 000),37 ℃孵育1 h;以HRP标记的羊抗鼠IgG为二抗(1∶10 000,稀释),37 ℃孵育1 h;多次洗涤后,加入TMB显色液,37 ℃避光孵育10 min;最后,加入50 μL终止液终止反应,在酶标仪下检测OD450nm。当ΔA=(A检测孔-A空白孔)/(A阴性孔-A空白孔)>2.1时,结果为阳性。出现阳性时最大稀释倍数即为抗体效价[12]。
1.2.7 间接免疫荧光抗体试验
在六孔板中制备EPC细胞爬片,待细胞长至90%时,以MOI(multiplicity of infection)0.1接种实验室保存的五株SVCV分离株,黑龙江3株(shlj1、shlj2和shlj3)及辽宁2株(ln201801和ln201802),同时设置不接种任何病毒的细胞为阴性对照组。当细胞出现CPE时,吸出培养液,用PBS多次清洗板孔后加入4%的多聚甲醛固定30 min;PBS再次清洗后加入细胞通透液进行室温通透20 min;将本实验制备的鼠抗血清(1∶1 000)以及FITC标记的羊抗鼠IgG(1∶500),依次加入到六板孔中,在37 ℃下各孵育1 h,最终用PBS清洗3次后,于荧光显微镜下观察结果。
2 结果与分析
2.1 G蛋白抗原指数预测
利用TMHMM Server在线分析软件对SVCV G蛋白的跨膜区域分析,结果显示该蛋白存在一个跨膜区域,位于468~487 aa(图1A)。同时利用DNAStar 6.0(Protean)软件对SVCV G蛋白抗原指数进行预测,结果如图1B所示。SVCV G全长蛋白平均抗原指数为1.025,其中1-160 aa区域平均抗原指数为1.009,且含有一段低抗原性的信号肽;161-300 aa区域蛋白平均抗原指数为1.048;301-500aa区域蛋白平均抗原指数为1.035。因此,本研究选定抗原指数最高的非跨膜区域的氨基酸序列(161-300 aa,140 aa)作为原核表达的目标蛋白序列。
2.2 重组质粒的构建及G蛋白的诱导表达
以SVCV shlj1病毒悬液提取的总RNA为模板,利用One Step RT-PCR Kit试剂盒扩增目的基因,1%琼脂糖凝胶电泳分析显示为单一特异性条带,且与预期设计的大小相符(420 bp,图2)。将G基因克隆至表达载体构建重组质粒pET-32a-G,并将其转入DH5α感受态中,经菌液PCR鉴定,出现与目的条带大小相吻合的单一特异性条带(420 bp,图3)。将菌液PCR鉴定为阳性的菌株,接种于LB液体培养基扩大培养后提质粒,进行酶切鉴定,可以看到重组质粒经BamH I或SalI单酶切后得到的单酶切产物与pET-32a-G质粒大小相符(6 320 bp,图4);而经BamH I和SalI双酶切得到的双酶切产物与目的片段大小相符(420 bp,图4)。将该阳性重组质粒pET-32a-G转入Rosetta表达菌株,利用PCR方法再次进行鉴定,结果显示获得的条带大小与目的片段相符(420 bp,图5)。
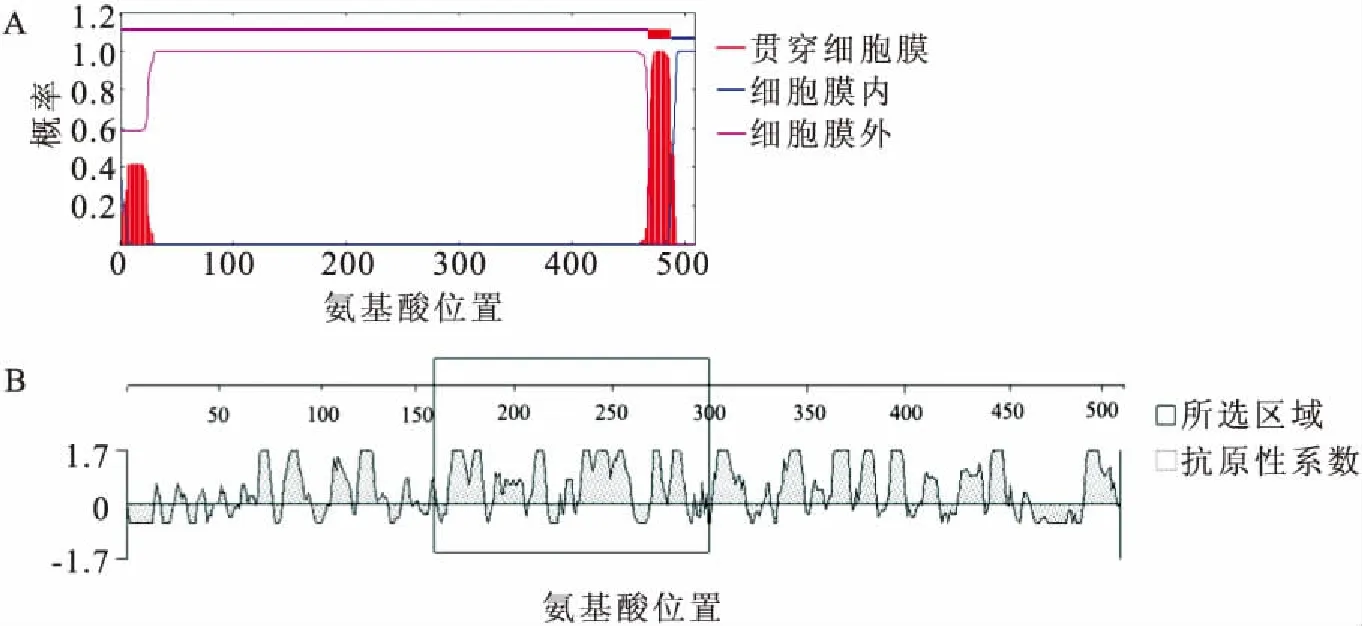
图1 G蛋白的跨膜区及抗原指数预测Fig.1 The transmembrane domain and antigenic determinants analysis of SVCV G proteinA:跨膜区域预测;B:抗原指数分析

图2 G基因PCR扩增的凝胶电泳分析Fig.2 Agarose gel analysis of G gene PCR productM.DL2000分子质量标准;1-2.G基因片段PCR产物

图3 pET-32a-G重组质粒PCR鉴定Fig.3 PCR identification of pET-32a-G recombinant plasmidM.DL2000分子质量标准;1.PCR阴性对照;2-6.PCR阳性鉴定产物

图4 pET-32a-G重组质粒酶切鉴定Fig.4 Dual-digestion of pET-32a-G recombinant plasmidM1.DL15000分子质量标准;1.pET-32a-G质粒;2.BamH I单酶切;3.Sal I单酶切;4.BamH I和Sal I双酶切;M2.DL2000分子质量标准

图5 含pET-32a-G质粒的Rosetta表达菌PCR鉴定Fig.5 PCR identification of the Rosetta carrying pET-32a-GM.DL2000分子质量标准;1.阴性对照;2-7.阳性鉴定产物
2.3 重组G蛋白的诱导表达
将未诱导的重组菌和诱导后重组菌的全菌、上清、沉淀进行SDS-PAGE电泳分析,结果显示沉淀中有明显的蛋白条带且大小与预期相符(35 kDa),而上清中未见目的条带(图6)。该结果说明重组G蛋白主要存在于沉淀中,以包涵体的形式进行表达;将阳性重组菌在37 ℃条件下诱导0~6 h,收集菌体沉淀,进行SDS-PAGE电泳分析,结果显示随着诱导时间的不断增加,目的蛋白含量不断增加,且诱导6 h时的蛋白表达量相对最高(图7)。因此,在后续试验中均选择6 h做为最佳诱导时间。
2.4 重组G蛋白的纯化
将重组G蛋白大量表达(37 ℃,6 h),收集菌体超声破碎,离心后用复性液对菌体进行多次清洗,向菌体中加入变性液,经变性过夜、复性8 h以及PBS缓冲液透析24 h后,对样品进行12% SDS-PAGE分析。结果显示,纯化后的G蛋白为单一条带,与目的条带大小相符,约为35 kDa(图8)。

图6 G蛋白可溶性分析Fig.6 Soluble analysis of G proteinM.蛋白分子质量标准;1.未诱导的菌体蛋白;2.诱导后的菌体总蛋白;3.诱导后的菌体上清蛋白;4.诱导后的菌体沉淀蛋白

图7 不同诱导时间对G蛋白表达的影响Fig.7 G protein expression induced for different timesM.蛋白分子质量标准;1.未诱导的菌体蛋白;2-6.诱导2~6 h的菌体蛋白

图8 纯化后的G蛋白Fig.8 Purified G proteinM.蛋白分子质量标准;1.纯化后的G蛋白
2.5 鼠抗血清效价的分析
对Balb/c小鼠进行3次免疫注射后,眼球取血,分离血清。以纯化后的重组G蛋白(终浓度为0.025 mg/mL)作为抗原包被酶标反应孔,以不同稀释度的鼠抗血清为一抗,HRP标记的羊抗鼠IgG为二抗(1∶10 000),进行ELISA检测,结果显示鼠抗血清稀释倍数为(10 000、20 000、40 000、80 000)时,满足ΔA>2.1,均呈阳性,与对照组相比差异显著(P<0.05)。稀释倍数为160 000时,ΔA<2.1,呈阴性(图9)。因此,本研究所制备的鼠抗SVCV G蛋白血清效价为1∶80 000。

图9 抗SVCV G蛋白血清效价的ELISA分析Fig.9 ELISA analysis of mouse anti-SVCV G sera
2.6 IFAT的建立及应用
将5株SVCV分离株(黑龙江3株:shlj1、shlj2、shlj3和辽宁2株:ln201801、ln201802)接种于EPC细胞爬片,待细胞病变后,收获病变的细胞进行固定和透化处理。然后分别加入制备的鼠抗血清为一抗,FITC标记的羊抗鼠IgG为二抗,进行间接免疫荧光抗体试验,设置不接种任何病毒的细胞为阴性对照组。结果显示,制备的鼠抗SVCV G截短蛋白血清均能与这5株SVCV分离株反应,产生特异性绿色荧光,而阴性对照组未见特异性荧光(图10)。
3 讨论
SVC是OIE必报的重要疫病,也是我国水生动物疫病监测计划的主要疫病之一。该病一旦爆发将会严重影响到我国鲤科鱼类养殖业的发展。因此,建立精准、快速的SVCV免疫学检测方法尤为重要[12]。当前用于检测的免疫血清通常是将灭活病毒免疫实验动物来获得,该方法需要增殖大量病毒,操作复杂,成本高[13]。随着分子生物学的发展,重组表达外源病毒蛋白已成为制备出高效的免疫血清的主要手段。SVCV G蛋白做为病毒入侵细胞的介体,直接参与病毒感染的过程,同时作为最主要的保护性抗原,有较强的免疫原性,能够决定血清型,是最常被用来制备免疫血清的蛋白[14]。
目前,SVCV G蛋白已在大肠杆菌、毕赤酵母和昆虫细胞中成功表达[15-17]。但无论是利用毕赤酵母还是杆状病毒表达SVCV G蛋白,均存在着表达量较低的缺点[18]。虽然原核表达系统无法对外源蛋白进行糖基化、磷酸化等翻译后的加工修饰,但其表达产物仍然具有较高的免疫原性,已被广泛应用于抗体的制备。如已利用大肠杆菌表达系统表达的抗原制备了IHNV及IPNV的抗体[11,19],并且这些抗体已经成功应用到病毒的血清学检测。因此,考虑到原核表达系统操作简单,成本低以及表达量高的优点,本研究选用大肠杆菌表达系统来表达SVCV G蛋白。兰文升等[13]将SVCV-741毒株G蛋白全长基因直接克隆至表达载体,发现SVCV G蛋白存在于上清,纯化后的蛋白浓度为1.7 mg/mL。而徐进等[20]采用截短表达方式去掉SVCV-HN毒株G蛋白两端的疏水区,结果证明截短表达的G蛋白浓度较高(4 mg/mL)。因此,本研究利用DNAStar 6.0(Protean)软件对SVCV G蛋白抗原指数进行预测,仅保留抗原指数最高的非跨膜区域(161~300 aa)进行截短表达。结果显示,本研究截短表达的SVCV G蛋白存在于沉淀当中,纯化后的蛋白浓度可高达4.2 mg/mL,且纯化的G蛋白条带单一,足够用于鼠抗血清的制备。经ELISA检测证明利用该截短G蛋白制备的鼠抗血清效价可高达1∶80 000。将该鼠抗血清应用于北方地区分离出的5株SVCV毒株的IFAT检测试验,结果显示本研究所制备的鼠抗血清能够识别SVCV表面天然结构G蛋白,均能与这5株SVCV分离株发生特异性反应,产生特异性荧光。上述结果表明,纯化的重组G蛋白具有良好的免疫原性,能够刺激机体产生特异性抗体。纪锋等[21]曾对SVCV-shlj1毒株G蛋白的抗原指数、亲水性指数以及柔性区域进行了预测分析,结果发现SVCV-shlj1毒株G蛋白可能存在5个优势抗原表位区域,分别为4~26 aa、145~157 aa、293~302 aa、315~327 aa、407~491 aa。本研究所选区域含有其中1个优势抗原表位区域(293~302 aa)。该优势抗原表位可能是本研究SVCV截短G蛋白具有良好免疫原性的主要原因。

图10 鼠抗SVCV G蛋白血清间接免疫荧光检测Fig.10 IFA result of the mouse antisera against SVCV G proteinA.阴性对照组(正常EPC细胞);B.SVCV-shlj1;C.SVCV-shlj2;D.SVCV-shlj3;E.SVCV-ln201801;F.SVCV-ln201802
目前我国SVCV现行基因型为Ia基因型。因此本研究选取Ia基因型的SVCV-shlj1毒株进行抗原制备。利用该抗原制备的鼠抗血清能够识别不同区域的5株SVCV分离株,该结果表明,本研究制备的鼠抗SVCV G蛋白血清可应用于全国范围的SVCV血清学检测。
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

