论文:高度耐药嗜水气单胞菌的定向诱导及其交叉耐药性分析
高度耐药嗜水气单胞菌的定向诱导及其交叉耐药性分析
张国亮1,吕利群1,2
(1.国家水生动物病原库,农业部淡水水产种质资源利用重点实验室,上海海洋大学水产与生命学院,上海 201306;2.淡水水产健康养殖湖北省协同创新中心,武汉 430070)
为了分析比较不同抗生素对耐药嗜水气单胞菌(Aeromonashydrophila)的诱导效率,从五大类抗生素中各挑选出一种代表性的抗生素,在针对嗜水气单胞菌菌株AH10的防耐药突变浓度(mutant prevention concentration,MPC)的琼脂平板上,分别筛选出五株耐药菌株,并对筛选的耐药菌株进行交叉耐药性分析,制定出这些耐药菌株对常用抗生素的最小抑菌浓度(minimal inhibitory concentrations,MIC)图谱。结果显示:四环素、氟苯尼考、磺胺嘧啶、硫酸新霉素、诺氟沙星对AH10的MIC分别为:1.0、0.5、8.0、8.0、0.25 μg/mL;MPC分别为4.0、3.0、128、88、2.0 μg/mL,分离的耐药菌株对所使用抗生素的MIC均提高100倍以上。4 ℃划线平板冰箱保存条件下,一个月内个别耐药菌株耐药性下降。在药物筛选压力下,菌株耐药性随着传代次数增多而表现出递增的趋势。同属一类抗生素耐药相关性较高;不同大类抗生素压力下筛选出来的耐药菌株表现出不同的交叉耐药性。
嗜水气单胞菌(Aeromonashydrophila);耐药性;抗生素;交叉耐药
由嗜水气单胞菌(Aeromonashydrophila)引起的细菌性败血症是水产养殖中较严重的疾病之一。水产养殖中被广泛应用于治疗败血症的抗生素有磺胺类、喹诺酮类、四环素类、酰胺类以及氨基糖苷类五大类。随着各类抗生素应用越来越广泛,鱼药滥用、混用现象严重。加上缺乏相应的规范性法律法规[1],导致耐药性问题日趋严重,多重耐药现象突出,给水产养殖病害防治带来很大的困难。
李爱华等[1]对嗜水气单胞菌耐药性进行了系统的研究,为研究多重耐药性提供了依据。李焕荣等[2]对采集的嗜水气单胞菌菌株进行了药物敏感性实验,发现耐药现象较为严重,且耐药性呈现增加的趋势。Kaskhedikar等[3]发现采集到的嗜水气单胞菌对青霉素产生的耐药率达到了100%。朱芝秀等[4]发现从江西分离的嗜水气单胞菌对不同抗生素均有耐药性,耐药率最高的达到94%。以上研究表明:嗜水气单胞菌耐药性在不同地区,不同年代略有差异,但总体偏高。耐药性一但产生,很难消失,且会引起更为复杂的耐药及多重耐药机制,影响深远[5]。
为了解在长期低剂量用药情况下嗜水气单胞菌的交叉耐药性及耐药变化情况,本研究从五大类抗生素中各挑选出一种代表性的抗生素,针对每种抗生素筛选出五株耐药菌株,对其进行最小抑菌浓度(MIC)图谱测定,绘制交叉耐药图谱,从而对比其耐药性及交叉耐药性,为临床用药提供有力依据。
1 材料与方法
1.1 菌株来源
本实验室从上海崇明某养殖场患典型嗜水气单胞菌性败血症濒死草鱼体内分离,鉴定后定名为嗜水气单胞菌AH10,现保存于上海海洋大学国家水生动物病原库。
1.2 试剂
Muller-hinton(MH)培养基购于北京陆桥科技有限公司;16S rDNA 引物由上海生工生物工程有限公司合成,27F:5′-AGAGTTTGATCATGGCTCAG-3′;1492R:5′-CTACGGTTACCTTGTTACGAC-3′。沙拉沙星购于南京精瑞久安生物技术有限公司,纯度为98%,批号为20131105;甲风霉素购于上海将来实业有限公司,纯度为98.5%,批号为JL140822005;氧氟沙星(纯度≥99%)、强力霉素(纯度≥98%)、磺胺嘧啶(纯度≥99%)、诺氟沙星(纯度≥98%)、四环素(纯度≥98%)、磺胺甲基嘧啶(纯度≥98%)、硫酸庆大霉素(纯度≥99%)、硫酸新霉素(纯度≥98%)均购于生工生物工程有限公司;恩诺沙星(纯度≥98.5%)购于浙江国邦药业有限公司,氟苯尼考(纯度≥98%)购于上海笛柏化学品技术有限公司。
1.3 原代菌株MIC、MPC测定
从划线保存的单个平板上挑取AH10单菌落于MH培养基中,培养16 h,参考陈俭清等[6]方法计数,将悬浮菌液浓度调整至106CFU/mL,抗生素浓度配制为1 280 μg/mL。将1.8 mL菌液与0.2 mL抗生素溶液充分混匀,参考戴自英等[7]2倍稀释法。30 ℃摇床培养24 h,以能抑制细菌生长的最小抗生素浓度为该抗生素对AH10的MIC。单菌落AH10接种于MH培养基过夜培养,计数后,4 000 r/min离心8 min,将菌液调整为3×1010CFU/mL,采用琼脂平板法[8],分别配制浓度为1 MIC~16 MIC抗生素平板,将调整好的菌液吸取100 μL涂布于平板上,72 h平板上没有长出菌落的最低浓度抗生素即为该抗生素对AH10的MPC。
1.4 耐药菌株获得及耐药获得速率评价
1.4.1 耐药性获得
将五种抗生素MPC平板上菌落数不大于5的平板上所长出的单菌落挑取后接种于MH培养基,过夜培养,取菌液划线,再次挑取单菌落接种于MH培养基,过夜培养,参考徐丽娟[9]的方法,采用16S rDNA通用引物进行PCR扩增。测序后,将所得序列与AH10菌株16S序列上传至美国国立信息技术生物中心(NCBI,登录号:KP999952)比对,相同者作为原代耐药株。
将得到的原代耐药菌株单菌落接种过夜培养,将所得菌液稀释至1×107CFU/mL[10],吸取100 μL到抗生素浓度分别为1 MIC~10 MIC的MH培养基中,过夜培养。第2天取最大抗生素浓度MH培养基中的菌液,划线,挑取单菌落,再次接种于MH培养基过夜培养后,将所得菌液稀释至1×107CFU/mL,吸取100 μL到抗生素浓度更高的MH培养基中过夜培养。如此反复操作,每次设置10个梯度,梯度间隔为1MIC,直到原代耐药株能在含有100 MIC抗生素浓度的MH培养基中生长。每传三代鉴定一次,所得序列与AH10菌株16S序列不同者舍去,细菌过夜培养12 h为1代。将抗生素诱导后的MIC=4倍诱导前MIC定为该菌株对该种抗生素耐药[10]。 按照此方法,共获得耐药菌株25株。将耐四环素的五株耐药菌株定名为:A1、A2、A3、A4、A5;将耐诺氟沙星的五株耐药菌株定名为:B1、B2、B3、B4、B5;将耐氟苯尼考的五株耐药菌株定名为:C1、C2、C3、C4、C5;将耐磺胺嘧啶的株耐药菌株定名为:D1、D2、D3、D4、D5;将耐硫酸新霉素的五株耐药菌株定名为:E1、E2、E3、E4、E5。
1.4.2 耐药获得速率
将每次传代测得的MIC值与最初的MIC值进行比较,绘制耐药获得速率图,对其耐药速率进行评价。
1.5 耐药菌株对常见抗生素的交叉耐药
1.5.1 交叉耐药
将最终耐氟苯尼考、四环素、诺氟沙星、硫酸新霉素、磺胺嘧啶的菌株分别挑取单菌落接种于MH培养基中,30 ℃培养24 h,按照本文1.3的方法对沙拉沙星、硫酸新霉素、氟苯尼考、磺胺嘧啶、诺氟沙星、强力霉素、氧氟沙星、恩诺沙星、四环素、甲风霉素、硫酸庆大霉素进行MIC的测定,绘制耐药图谱。
1.5.2 交叉耐药比率
每株耐药菌株均是由抗生素诱导,除去诱导该菌株产生耐药性的抗生素,交叉耐药程度的判断公式为:
菌株的交叉耐药比率=(M-1/F-1)×100%。
M表示该菌株所耐抗生素数。F表示该菌株所测试抗生素总数。分析比较耐药百分比,绘制耐药百分比图谱,百分比越高,交叉耐药越显著[11]。
1.5.3 耐药菌株对各种抗生素耐药比率
氟苯尼考、四环素、诺氟沙星、硫酸新霉素、磺胺嘧啶为诱导AH10耐药的抗生素,除去本身诱导的5株耐药菌株,耐药比率判断公式为:
耐药比率=(耐该种抗生素的耐药菌株总数-5/该种抗生素测试的耐药菌株总数-5)×100%。
未诱导菌株产生耐药性的抗生素,耐药比率判断公式为:
耐药比率=(耐该种抗生素的耐药菌株总数/该种抗生素测试的耐药菌株总数)×100%。
1.6 耐药菌株保存条件
将终耐药菌株分别均匀涂布于平板上,分别于4 ℃下保存5 、10 、15 、20 、25、30 d,挑取单菌落,扩大培养后按照本文1.3的方法,进行MIC测定,探讨其耐药稳定性。
2 结果与分析
2.1 原代菌株AH10体外测试结果
经测试诺氟沙星、恩诺沙星、氧氟沙星、沙拉沙星、四环素、强力霉素、硫酸新霉素、氟苯尼考、甲风霉素、硫酸庆大霉素、磺胺嘧啶对AH10的MIC分别为:0.25、0.25、0.25、0.25、1.0、0.25、8.0、0.5、1.0、0.5、8.0 μg/mL,诺氟沙星、磺胺嘧啶、氟苯尼考、四环素、硫酸新霉素对AH10的MPC分别为:2.0、128、3.0、4.0、88 μg/mL。根据原始嗜水气单胞菌AH10的体外药效参数,确定耐药菌株筛选时MH培养基中抗生素添加量。
2.2 供试菌株随传代次数对五种筛选抗生素的平均耐药性及获得速率
供试菌株在供试药物连续传代培养100次中,在各种抗生素筛选压力下,耐药菌株随传代次数增加其耐药性逐步增加,但在抗生素压力下,传代在10~25次之间,耐药菌株耐药性并无明显增加,甚至略有下降,且耐药性极不稳定。传代至35次稳定耐药后,其耐药性逐步增加,但传代至55~65次时,耐药性增长速率减慢,耐药性基本保持不变,随后耐药性大幅度增加(图1)。耐药性增加速率呈现不规则变化,在传代至10~25次之间,出现了负增长,在传代至65~95次之间MIC增长倍数一直处于12倍左右,与耐药性增长趋势相吻合(图1)。
2.3 耐药菌株交叉耐药
A1、A2、A3、A4、A5耐药性提高均在100 μg/mL(100倍MIC)以上(表1),对同为四环素类的强力霉素耐药性提高较大,耐药性提高最小的达到15.75 μg/mL(100倍MIC);对磺胺嘧啶、氟苯尼考耐药性提高非常大,其中对氟苯尼考的耐药性提高达到60 μg/mL以上,对磺胺嘧啶的耐药性更是达到了100 μg/mL以上;对硫酸新霉素耐药性未提高。B1、B2、B3、B4、B5耐药性提高在50 μg/mL(200倍MIC,表2)以上,沙拉沙星与氧氟沙星同为喹诺酮类,但对氧氟沙星耐药性提高达到3.75 μg/mL(15倍MIC),对沙拉沙星耐药性未明显提高;对酰胺类和四环素类耐药性提高较大,对氟苯尼考耐药性提高更是达到50 μg/mL(100倍MIC)以上;对磺胺类耐药性同样提高幅度较大,提高都在20 μg/mL(表2)以上。C1、C2、C3、C4、C5耐药性均由最初的0.5 μg/mL提高到128 μg/mL以上[大于200倍MIC(表3)],对同为酰胺类的甲风霉素的耐药性提高在50 μg/mL(50倍MIC)以上,对四环素类提高同样较为明显,对喹诺酮类和氨基糖苷类耐药性提高较小。D1、D2、D3、D4、D5对磺胺嘧啶耐药性提高均在100 μg/mL以上。D1、D2、D3、D4、D5对四环素类和酰胺类抗生素耐药性提高较明显,未发现对氨基糖苷类产生明显耐药,对硫酸新霉素的耐药性出现下降(表4)。对比表1、表3、表4我们发现耐药株对磺胺类、酰胺类和四环素类抗生素耐药相关性较为一致(即对这三类中的一类抗生素产生耐药对另外两类抗生素耐药性同样较为明显)。E1、E2、E3、E4、E5耐药性提高在120 μg/mL[15倍MIC(表5)],对氟苯尼考表现出耐药性,对其他各大类抗生素耐药性与AH10对比无明显变化。
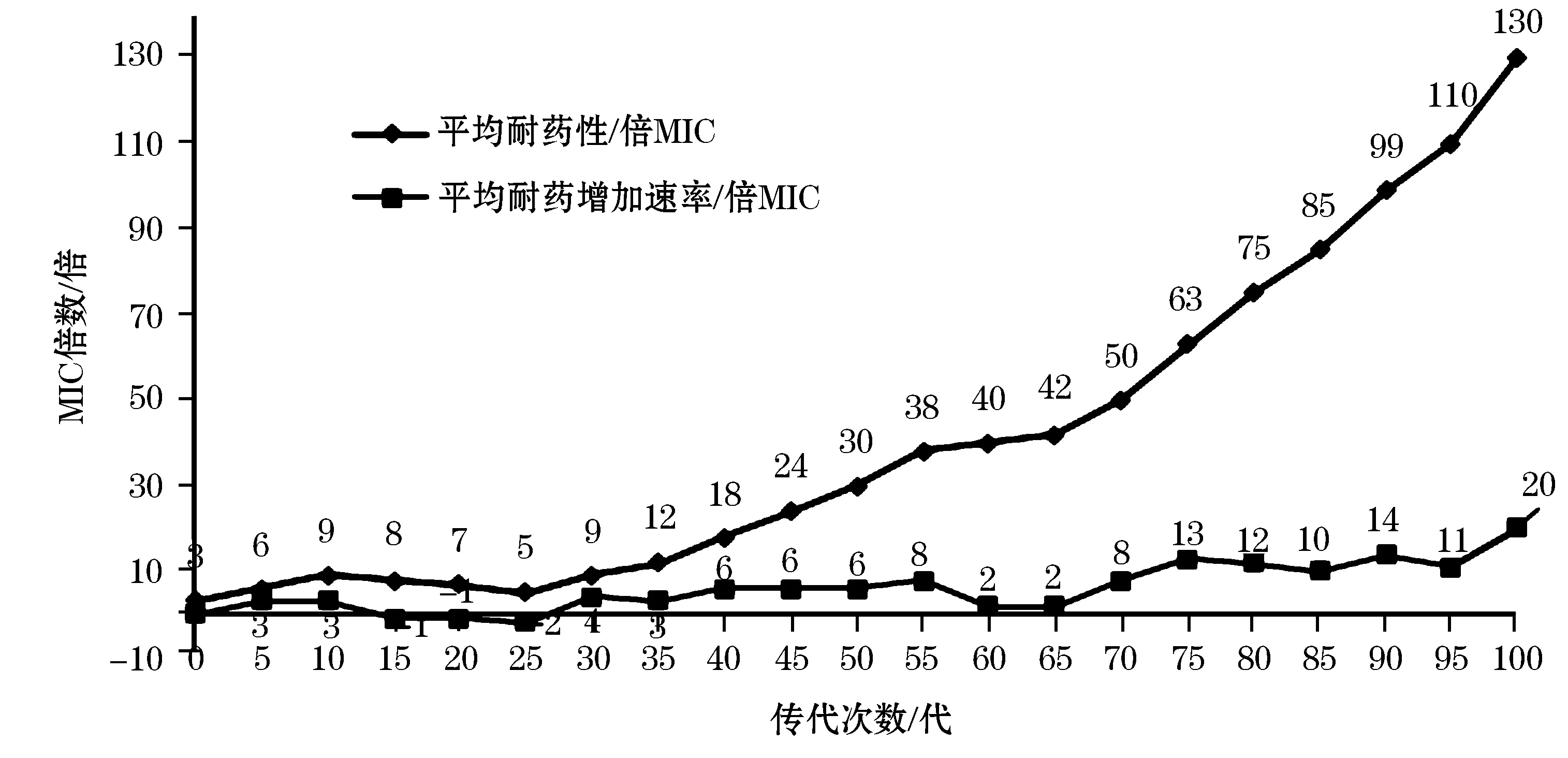
图1 耐药菌株随传代次数的平均耐药性和平均增加速率

表1 耐四环素菌株对常见抗生素的交叉耐药
2.4 耐药菌株交叉耐药比率
由图2可以看出,菌株耐药后交叉耐药现象明显,耐喹诺酮类菌株对另外四大类抗生素耐药性提高最明显,平均交叉耐药比率为74.0%。耐四环素类菌株交叉耐药性同样较为明显,平均交叉耐药性为66.68%,而氨基糖苷类耐药菌株则相对交叉耐药率较低,平均耐药率不足20%。耐酰胺类菌株平均交叉耐药性为56.0%,且耐药后各耐药株对另外四类抗生素交叉耐药各异。耐磺胺类菌株交叉耐药性则相对接近,平均耐药性为48%。

表2 耐诺氟沙星菌株对常见抗生素的交叉耐药

表3 耐氟苯尼考菌株对常见抗生素的交叉耐药

表4 耐磺胺嘧啶菌株对常见抗生素的交叉耐药

图2 筛选药物外耐药菌株耐药比率
2.5 耐药菌株对各种抗生素的耐药比率
耐药菌株耐药比率很高,但差异较大(图3),对氟苯尼考耐药率最高,达到了85%。然而对硫酸新霉素未表现出交叉耐药性。对磺胺嘧啶、四环素、甲砜霉素的耐药率均达到了75%。

图3 筛选药物外耐药菌对抗生素耐药比率
2.6 耐药菌株4℃条件下保存耐药稳定性
由表6可以看出,耐药菌株在4 ℃划线平板保存条件下,耐药性出现波动,耐药保存一个月后,C1、C2、E2下降为原来的1/2。

表6 耐药菌4 ℃保存下 MIC

续表6
3 讨论
细菌在对抗一种抗生素时,往往同时有两种或两种以上的耐药方式[12],这与本研究中同一种抗生素诱导产生的耐药菌株,其交叉耐药性有很大差异相吻合。从耐四环素类菌株与耐酰胺类菌株呈现出高度的相关性我们可以看出:这两类抗生素产生的耐药株可能存在着相似的耐药途径。氨基糖苷类耐药菌株耐药后,交叉耐药现象并不显著,甚至有些耐药菌株的MIC相比AH10略有下降,说明这类耐药菌可能有其特有的耐药方式。 嗜水气单胞菌在长期低剂量抗生素环境下,耐药性随着传代次数不断增加,但在平板保存条件下,耐药性随保存时间的延长却不断改变,呈现出下降的趋势,这表明:耐药性变化与其所处的环境有直接的联系。
嗜水气单胞菌耐药机制多样[13],尤其是抗生素被广泛应用以来,细菌耐药性迅速增加,耐药机制也变得越来越复杂。张丹凤等[14]发现获得性药物外排基因Armb对氨基糖苷类耐药起到重要作用,与本研究中氨基糖苷类特有的耐药方式相吻合;周万蓉[15]和方一凤等[16]发现磺胺类和喹诺酮类耐药均可能为质粒介导,可被多种抗生素所诱导,这也与本研究中这两类抗生素诱导的耐药株交叉耐药现象严重相一致。莫岚等[17]对酰胺类抗性基因PBPs系统做了较为深入的研究,PBPs系统广泛存在于细胞膜表面,通过细胞膜表面蛋白的改变来阻止药物的侵害,该系统介导耐药性可广泛扩散。本研究中喹诺酮类、四环素类和磺胺类耐药株均对酰胺类产生了耐药,说明这三类抗生素诱导的耐药株耐药性变化与细胞膜PBPs系统不无关系。蒋红霞等[18]报道:耐药机制与酶的改变、染色体、质粒、膜蛋白以及通透屏障等众多因素有关,既有遗传稳定性耐药机制,又有非遗传稳定性耐药机制,研究4 ℃保存条件下耐药性的变化可能由非遗传稳定性耐药机制引起。
为减少耐药性产生,在防治嗜水气单胞菌引起的疾病过程中,应首先对其进行最小抑菌浓度(MIC)测定,在MIC大小相似的情况下,应注意轮换使用不同大类的抗生素。本研究发现,嗜水气单胞菌耐药性与抗生素的接触次数有关,接触次数越多,则耐药性增加越明显。磺胺类、喹诺酮类以及氨基糖苷类易产生交叉耐药性,且磺胺类和氨基糖苷类抗生素防治效果不佳,此三类抗生素应酌情选用。四环素类和酰胺类抗生素耐药交叉率较低,且这两类抗生素不易产生耐药性,应作为首选。因此,在养殖中应充分了解各种抗生素对病原菌的抑制效果,做到定期检测[19],采样研究,充分掌握第一手资料。建立用药标准制度,严格按照用药标准用药,尤其应该建立完整的交叉耐药标准制度,建立起无公害的防治体系,保证我国水产养殖业健康可持续发展。
[1]李爱华,蔡桃珍,吴玉深,等.我国鱼类病原——嗜水气单胞的耐药性研究[J].微生物学通报,2001,28(1):58-63.
[2]李焕荣,田丽英,崔德凤,等.致病性嗜水气单胞菌对31种抗菌药物的敏感试验[J].北京农学院学报,2001,16(3):34-37.
[3]Kaskhedikar M,Chhabra D.Multiple drug resistance ofAeromonashydrophilaisolates from Chicken samples collected from Mhow and Indore city of Madhyapradesh[J].Veterinary World,2009,2(1):31-32.
[4]朱芝秀,何后军,邓舜洲,等.嗜水气单胞菌江西地区分离株耐药性及耐药质粒分析[J].江西农业大学学报,2012,34( 6) :1262-1268.
[5]林居纯,罗忠俊,舒 刚,等.嗜水气单胞菌临床分离菌对抗菌药物的耐药性调查[J].安徽农业科学,2009,37(15):7024 -7025.
[6]陈俭清,卢彤岩,刘红柏,等.恩诺沙星对嗜水气单胞菌的体外药效学研究[J].水产学杂志,2010,23(1):47-50.
[7]戴自英,临床抗菌药物学[M].北京:人民卫生出版社,1985:6-8.
[8]荆靓艳.6种氟喹诺酮类药物对葡萄球菌防耐药变异浓度的研究[D].辽宁大连:大连医科大学,2008.
[9]徐丽娟.恩诺沙星控制淡水鱼类嗜水气单胞菌性败血症的防耐药用药方案研究[D].上海:上海海洋大学,2014.
[10]王美珍,陈昌福,刘振兴,等.嗜水气单胞菌对四环素类和氟喹诺酮类药物的耐药性研究[J].华中农业大学学报,2011,30(1):89-93.
[11]张健騑,李跃龙,陈鲜花,等.禽致病性大肠杆菌对氟喹诺酮类药物交叉耐药性研究[J].广东农业科学,2005,(2):74-76.
[12]夏永祥.临床抗生素的应用和细菌耐药性分析[J].实用全科医学,2003,1(4):331-333.
[13]夏 飞,梁利国,谢 骏,.嗜水气单胞菌耐药性研究进展[J].江苏农业科学,2012,40(10):16-18.
[14]张丹凤,陈国平,张国广,等.AmrB对嗜水气单胞菌氨基糖苷类抗生素耐药性的影响[J].中国农业科技导报,2013,15(3):123-128.
[15]周万蓉.细菌对磺胺类药物耐药基因三重PCR检测试剂盒研制与应用[D].四川雅安:四川农业大学,2007.
[16]方一风,潘晓艺,蔺凌云,等.嗜水气单胞菌对喹诺酮类药物耐药的分子机制[J].微生物学报,2014,54(2):174-182.
[17]莫 岚.青霉素结合蛋白与细菌对β-内酰胺类抗生素耐药机制的研究进展[J].国外医药(抗生素分册),1996,17(3):187-191+223.
[18]蒋红霞,曾振灵.细菌耐药机制及耐药性控制对策[J].动物医学进展,2001,22(4) :4-7.
[19]孟小亮,陈昌福,吴志新,等.嗜水气单胞菌对盐酸多西环素的耐药性获得与消失速率研究[J].长江大学学报(自然科学版农学卷),2009,6(1):42-44,58,112.
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

