论文:氨氮对鱼类的毒性及鱼类应对氨氮毒性的策略
氨氮对鱼类的毒性及鱼类应对氨氮毒性的策略
付莹,赵玉蓉
(湖南农业大学湖南畜禽安全生产协同创新中心,湖南 长沙 410128)
在集约化养殖下,水体中常出现毒性物质氨的过量积累,对鱼类造成不良影响,如抑制生长[1-6]、影响能量代谢[7,8]、阻碍离子平衡[9]、降低机体免疫功能[10,11]、器官病理等变化[12,13]。鱼类能在一定范围内采取适应机制缓解氨毒。
1 水体中氨氮的来源
天然水中氨的浓度约为0~0.2mg/L,处于较低水平。养殖水体中的氨氮主要来自残饵和鱼类排泄物等含氮有机物的降解。而高密度集约化养殖加大了水体含氮物质的负荷,造成氨氮积累;外界氨氮污染水,如工业废水、生活污水、畜禽养殖污水和农业径流等排入水体中时,更加重了水体氨氮的负荷。过高的水体氨氮含量不仅引起水体富营养化,还会毒害水生动物。
2 水体中氨氮的存在形式
水体中的氨氮以离子氨(NH4+)和分子氨(NH3)两种形式存在,通常说的氨氮(或总氨)是指两者含量的总和,二者的平衡反应方程如下:
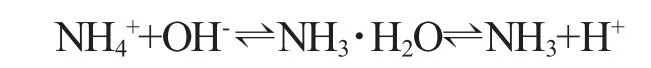
氨的毒性常以总氨(NH3+NH4+)的浓度表示,一般化学分析方法(奈氏试剂法、水杨酸法等)测定的氨含量均为总氨的含量。
3 影响水体氨氮毒性的因素
影响水体氨氮毒性的因素主要有两方面:环境因素和生物自身。
3.1 环境因素
3.1.1 pH和温度
NH3为亲脂性分子,半径较小,比NH4+更易透过脂质性生物膜进入体内,使机体氨氮浓度升高,危害机体。水体中NH3的浓度可直观反映水体中氨氮的毒性,NH3浓度越高氨氮毒性越强。但两者在水体中的比例受多种因素影响。Emerson指出,淡水中NH3的比例可按下式计算:
[NH3]=[NH3+NH4+]/(10pka+pH+1)
pKa=(0.09108+2729.92)/(273.2+T)
其中,pKa 为解离常数,[NH3+NH4+]和[NH3]为总氨氮和非离子氨的浓度,T为摄氏温度[14]。
一般认为,当OH-的浓度随着pH的增加而增加时,使NH3·H20的平衡向生成NH3的方向进行,使NH3的浓度增加,氨氮毒性增强[15],pH仅增大0.4时,NH3的浓度就会翻倍。Weirich等[16]研究发现,鲈Lateolabrax japonicus对氨氮的吸收速率随pH的上升而增加。总之,pH升高不仅会增加水体NH3的浓度,还会加快鱼体对氨氮的吸收。
Ktr等[17]研究表明,对虾的NH3半致死浓度与温度呈负相关,即水体氨氮毒性随着温度的升高而加剧。这是因为温度升高时,机体的新陈代谢加快,促进了鱼体对外界物质(包括水体中的氨)的吸收[18]。温度还影响细胞膜的渗透性、内源性氨的产生。但温度对氨氮毒性的影响小于pH。
3.1.2 溶解氧
有研究表明,NH3的毒性随水体溶解氧浓度减少而升高[19];高浓度的溶解氧有利于消除氨毒[20]。这可能是因为水中高浓度的溶解氧有利于缓解氨机体血液载氧能力的下降,促进NH3从水体溢出;或者有利于机体内有毒的氨氮转化为无毒的硝酸盐等,缓解氨毒。
3.1.3 盐度
在一定范围内,鱼类的排氨率随水中盐度的增加而增大[21-23]。鱼鳃上皮中的主要用于维持机体水盐平衡的Na+/NH4+交换系统随着盐度的增加而变得活跃,调动更多NH4+参与该系统而排出体外,使机体的氨氮排泄率升高[24]。海水盐度较低时不利于氨从鱼体排出,使氨在体内过量累积,加剧氨氮对机体的负面影响[25,26]。
3.2 生物本身
除环境因素外,水生动物种类、规格、体质等也影响水体氨氮的毒性。水生生物对氨氮的敏感性因种类而异。一般海水生物对氨氮的敏感性高于淡水生物[27],无脊椎生物高于脊椎生物[28],其中淡水贝类高于其他淡水生物。同种生物,通常幼龄期对氨氮较为敏感[29]。
4 氨氮致毒机理
水体中NH3含量≤0.02mg/L时,鱼类生长、繁殖等生命活动基本不受影响,当水体NH3浓度超出该范围时,则会危害鱼体[30]。在水中,NH3容易透过生物膜进入体内而迅速转化成NH4+。机体内95%的氨氮以NH4+的形式存在[31]。
关于鱼类氨氮胁迫已做了大量的研究,但其致毒机理至今尚不明确。一般认为NH3是经鱼的鳃、表皮和肠粘膜等进入机体,使血液pH增加,血液的载氧能力降低。长期接触氨也会损害鳃组织,导致鳃组织充血、鳃小片弯曲、粘连和融合等,影响鳃的气体交换[32],抑制机体的呼吸机能,导致个体缺氧甚至死亡。氨扩散进入各组织后,组织氨氮含量升高[33,34],损伤肝肾系统,出现充血、水肿、肝昏迷甚至死亡[35]。
其次,氨还会损害鱼类的中枢神经系统,其中毒机制与哺乳动物肝脑病极为相似。目前发现,哺乳动物氨中毒的机制主要为:氨导致谷氨酰胺(Gln)在体内过量积累,使神经胶质细胞肿大,激活N-甲基-D天冬氨酸受体(NMDA受体)[36]。正常情况下,机体主要通过谷氨酸(Glu)和NH4+生成Gln以去除脑中多余的NH4+。因此,脑中NH4+浓度升高常伴随着Gln含量升高。而Gln在胞内过量增加易导致星型胶质细胞肿大,引发脑水肿[37]并促进Glu释放进入细胞间。对鱼类的研究表明,即使出现谷氨酰胺累积时,也未出现脑水肿现象[38],这与哺乳动物不同。此外,NH4+还能引起神经元表面去极化。胞间累积的Glu和去极化的神经元二者均能激活位于神经元表面的NMDA受体。该受体的过量激活促进NO合成[39,40],激活Na+/K+-ATP酶。Na+/K+-ATP酶的激活会加快脑中能量消耗,过量的NO不仅增加机体氧化应激,还易产生高毒性过氧化氮,损害线粒体呼吸,引发ATP耗竭,导致细胞死亡[41,42]。相关研究表明,哺乳动物体内注射NMDA受体拮抗剂(MK801等)能够延迟甚至消除氨毒的负面影响[43,44],但MK801并不对所有鱼类有效。在氨氮胁迫下,MK801对泥鳅Misgurnus anguillicaudatus具有保护效果[45],同剂量MK801对弹涂鱼Periophthalmodon schlosseri和薄氏弹涂鱼Boleophthalmus boddaerti却无效果[46]。
5 鱼类应对策略
在一定范围内,鱼类能将体内的氨转化为谷氨酰胺和尿素,减少体内氨的产生,增加NH3的挥发和NH4+的排放,减缓或解氨毒(图1)。

图1 鱼类的解毒策略Fig.1 The strategy of nitrogen detoxification in fish
5.1 转化为低毒性的物质
5.1.1 谷氨酰胺
在高浓度氨的水体中,大多数鱼类能够将体内的NH4+转化为无毒的Gln,以迅速解毒。Gln由Glu和NH4+在谷氨酰胺合成酶(GS)的催化下生成,而Glu又可由α-酮戊二酸(α-KG)和NH4+生成。如果以α-KG为合成起点,每合成1mol Gln能消耗2mol NH4+。Sinha等[47]研究表明,暴露在高浓度环境氨的情况下,虹鳟Oncorhynchus mykiss、金鱼Carassius auratus和鲤Cyprinus carpio体内Gln水平均高于对照组,但最终维持在一定水平而不再增加。
5.1.2 尿素
到目前为止,仅发现少数硬骨鱼类,如罗非鱼Oreochromis grahami、肺鱼 Protopterus dolloi、蟾鱼Opsanus beta等能利用尿素合成解氨毒,大多数硬骨鱼并不利用该途径解毒。这可能因为尿素合成是一个极其耗能的过程。在尿素循环中,每生成1mol尿素要消耗4mol高能磷酸键。
软骨鱼类可以合成尿素增加身体的渗透性,甚至以尿素的形式将大多数含氮废物从鳃中排出。组成软骨鱼鳃膜的大量胆固醇和基底细胞膜上的尿素/Na+逆向转运体,通过耦合作用实现对尿素的低渗透性,将尿素转运回血液中,以维持体内高浓度的尿素[48]。当面临氨氮胁迫时,鱼可以将体内的氨以尿素的形式直接经鳃排出体外。
5.2 减少体内氨的产生
鱼体内源性氨主要来源于蛋白质的分解代谢,由肝脏所产生。在剧烈运动时,肌肉中氨基酸和腺苷酸的脱氨基作用也会产生氨。一般鱼体内产生的氨由鳃排出体外,但在一些极端条件下,如外界高氨、高pH和缺水等,氨的排放会受到抑制而在体内积累。有研究表明,在碱和空气暴露的情况下,鱼体能通过降低蛋白质和氨基酸的分解代谢避免体内氨的过量积累[49,50]。
5.3 NH3挥发
Tsui等[51]研究表明,泥鳅暴露在氨氮和空气条件下,能以NH3的形式将氨挥发出体外。在氨氮胁迫、pH显著升高时,肠道作为泥鳅的辅助呼吸器官,可能是NH3挥发的位置。在自然界,泥鳅面临干旱(空气暴露)时,往往会钻入泥土中。在空气暴露下,泥鳅体表的pH显著升高[52]。体表也可能是NH3挥发的位置。但到目前为止,NH3挥发的具体位置尚无定论。
5.4 NH4+的排放
Wilson和Taylor[53]发现,在高浓度氨环境下,虹鳟在淡水和海水中分别能进行NH4+/H+和NH4+/Na+交换,将体内部分氨排出体外,以应对水中高浓度的氨。Randall等[55]也发现,无论在高浓度的氨水中或暴露于空气中,弹涂鱼均能排放NH4+。Wilson等[56]提出,鳃复杂结构,充满大量血液,与外界接触面积很大,是进行气体交换的重要位置,很可能与NH4+的排放有关。因为在鳃上皮泌氯细胞的基底外侧膜上,含有大量氨敏感型的Na+/K+ATP酶和Na+/K+/Cl-协同转运蛋白,两者能将NH4+转入泌氯细胞内,进入细胞的NH4+可通过Na+/H+(NH4+)交换载体排出体外(图2)。

图2 鱼类鳃上皮细胞NH4+交换模型Fig.2 NH4+exchange model in gill epithelial cells of fish
6 结语
氨为一种有毒物质,对鱼类的致毒机理尚不明晰,不同鱼类缓解氨毒的能力也不尽相同。目前,通过饲料添加剂,如维生素C、维生素E、γ-氨基丁酸、壳聚糖等提高鱼体的抗氧化和免疫能力,提高机体抗氨氮胁迫能力[56-61]的研究已有不少。但在日粮中添加营养调控剂,补偿尿素合成的能量消耗,促进尿素合成以缓解鱼类氨氮胁迫,以及通过平衡饲料氨基酸,减少含氮物质的产生,减缓鱼类氨氮胁迫还有待进一步研究。
[1]李波,樊启学,杨凯,等.慢性氨氮胁迫对黄颡鱼摄食、生长及血液指标的影响[J].应用与环境生物学报,2011,17(6):824-828.
[2]肖炜,李大宇,徐杨,等.慢性氨氮胁迫对吉富罗非鱼幼鱼生长、免疫及代谢的影响[J].南方水产科学,2015,11(4):81-87.
[3]黄厚见.摄食水平、氨氮胁迫对梭鱼幼鱼生长的影响及其毒理效应研究[D].上海:上海海洋大学,2012.
[4]Lemarié G,Dosdat A,Covès D,et al.Effect of chronic ammonia exposure on growth of European seabass(Dicentrarchus labrax)juveniles [J].Aquaculture,2004,229(1):479-491.
[5] Foss A,Siikavuopio S I,Sæther B S,et al.Effect of chronic ammonia exposure on growth in juvenile Atlantic cod[J].Aquaculture,2004,237(1-4):179-189.
[6]Kolarevic J,Selset R,Felip O,et al.Influence of long term ammonia exposure on Atlantic salmon(Salmo salar,L.)parr growth and welfare[J].Aquaculture Research,2013,44(11):1649-1664.
[7]Wang X,Wang L,Yao C,et al.Alternation of immune parameters and cellular energy allocation of Chlamys farreri under ammonia-N exposure and Vibrio anguillarum challenge [J].Fish&Shellfish Immunology,2012,32(5):741-749.
[8]王鑫,李荣,刘东超,等.氨氮对红鳍东方鲀生长及能量收支的影响[J].水产科学,2014,33(7):433-437.
[9]Chen J C&Lee Y.Effects of nitrite exposure on acid-base balance,respiratory protein,and ion concentrations of giant freshwater prawn Macrobrachium rosenbergii at low pH[J].Archives ofEnvironmental Contamination&Toxicology,1997,33(3):290-297.
[10]黎庆,龚诗雁,黎明.慢性氨氮暴露诱发黄颡鱼幼鱼谷氨酰胺积累、氧化损伤及免疫抑制的研究[J].水产学报,2015,39(5):728-734.
[11]赵海涛.氨氮对南方鲶(Silurus meridionalis Chen)幼鱼血液生理、生化及非特异性免疫指标的影响[D].重庆:西南大学,2006.
[12]周鑫,董云伟,王芳,等.急性氨氮胁迫对于草鱼sod和hsp90基因表达及鳃部结构的影响[J].水生生物学报,2013,37(2):321-328.
[13]张武肖,孙盛明,戈贤平,等.急性氨氮胁迫及毒后恢复对团头鲂幼鱼鳃、肝和肾组织结构的影响[J].水产学报,2015,39(2):233-244.
[14]Emerson K,Russo R C,Lund R E,et al.Aqueous ammonia equilibrium calculations:effect of pH and temperature[J].Journal De L’office Des Recherches Sur Les Pêcheries Du Canada,2011,32(12):2379-2383.
[15]罗杰,杜涛,刘楚吾,等.不同盐度、pH条件下氨氮对管角螺稚贝毒性影响[J].动物学杂志,2010,45(3):102-109.
[16]Weirich C R,Tomasso J R&Smith T I J.Toxicity of ammonia and nitrite to sunshine bass in selected environments[J].Journal ofAquatic Animal Health,1993,5(1):64-72.
[17]Ktr M,Kumlu M&Eroldo an O T.Effects of temperature on acute toxicity of ammonia to Penaeus semisulcatus,juveniles[J].Aquaculture,2004,241(1-4):479-489.
[18]Mummert A K,Neves R J,Newcomb T J,et al.Sensitivity ofjuvenile freshwater mussels(Lampsilis fasciola,Villosa iris)to total and un-ionized ammonia[J].Environmental Toxicology&Chemistry,2003,22(11):2545-2553.
[19]Thurston R V,Russo R C&Vinogradov G A.Ammonia toxicitytofishes.Effect ofpH on the toxicity ofthe unionized ammonia species[J].EnvironmentalScience&Tech-nology,1981,15(7):837-840.
[20]李波,樊启学,张磊,等.不同溶氧水平下氨氮和亚硝酸盐对黄颡鱼的急性毒性研究[J].淡水渔业,2009,39(3):31-35.
[21]唐贤明,隋曌,田景波,等.盐度对大菱鲆幼鱼耗氧率和排氨率的影响[J].南方水产科学,2006,2(4):54-58.
[22]Chen J C&Nan F H.Changes ofoxygen consumption and ammonia-N excretion by Penaeus chinensis Osbeck at different temperature and salinity levels [J].Journal of Crustacean Biology,1993,13(4):706-712.
[23]柴学军,胡则辉,徐君卓,等.盐度和pH对日本黄姑鱼幼鱼耗氧率和排氨率的影响[J].浙江海洋学院学报:自然科学版,2009,28(2):146-150.
[24]江敏,黄宗群,彭自然,等.异育银鲫氨氮排泄与耗氧的研究[J].上海海洋大学学报,2007,16(1):28-32.
[25]胡贤德,孙成波,蔡鹤翔,等.不同盐度条件下氨氮对斑节对虾的毒性试验[J].广西科学,2009,16(2):206-209.
[26]吕富,黄金田,吕林兰,等.不同盐度条件下氨氮对双齿围沙蚕的毒性研究[J].安徽农业科学,2009,37(7):2986-2987.
[27] Randall D J&Tsui T K.Ammonia toxicity in fish[J].Marine Pollution Bulletin,2002,45(1-12):17-23.
[28]刘炎.环境因子对氨氮毒性影响及氨氮水生生物基准校验[D].南京:南京大学,2014.
[29]EPA-822-D-09-001,Draft 2009 Update of Aquatic Life Ambient Water QualityCriteria for Ammonia-Freshwater[S].Washington,DC,2009.
[30]GB11607-89,中华人民共和国渔业水质标准[S].北京:中国标准出版社,1990.
[31]Ip YK,ChewSF&Randall D J.Ammonia toxicity,tolerance,and excretion[J].Fish Physiology,2001,20(1):109-148.
[32]Benli A C K,Köksal G&Özkul A.Sublethal ammonia exposure of Nile tilapia (Oreochromis niloticus L.):effects on gill,liver and kidneyhistology[J].Chemosphere,2008,72(9):1355-1358.
[33]Wilkie M P,Pamenter M E,Duquette S,et al.The relationship between NMDA receptor function and the high ammonia tolerance ofanoxia-tolerant goldfish [J].Journal ofExperimental Biology,2011,214(24):4107-4120.
[34]李波,樊启学,杨凯,等.慢性氨氮胁迫对黄颡鱼摄食、生长及血液指标的影响[J].应用与环境生物学报,2011(6):824-828.
[35]乔顺风,李红顺.水体生物急性氨中毒的成因和调控技术[J].河北渔业,2005(2):27-29.
[36]Wee NLJ,TngY Y M,ChengH T,et al.Ammonia toxicity and tolerance in the brain of the African sharptooth catfish,Clarias gariepinus[J].Aquatic Toxicology,2007,82(3):204-213.
[37] Jayakumar A R&Norenberg M D.The Na-K-Cl co-transporter in astrocyte swelling[J].Metabolic Brain Disease,2010,25(1):31-38.
[38] Veauvy C M,Mcdonald M D,Van Audekerke J,et al.Ammonia affects brain nitrogen metabolism but not hydration status in the gulf toadfish (Opsanus beta)[J].Aquatic Toxicology,2005,74(1):32-46.
[39] Rao V L R.Nitric oxide in hepatic encephalopathy and hyperammonemia[J].NeurochemistryInternational,2002,41(2-3):161-170.
[40]Rodrigo R,Erceg S&Felipo V.Neurons exposed to ammonia reproduce the differential alteration in nitric oxide modulation of guanylate cyclase in the cerebellum and cortex of patients with liver cirrhosis[J].Neurobiology of Disease,2005,19(1-2):150-161.
[41]Rodrigo R,Cauli O,Boix J,et al.Role ofNMDA receptors in acute liver failure and ammonia toxicity:therapeutical implications[J].Neurochemistry International,2009,55(1-3):113-118.
[42]Braissant O,Mclin V A&Cudalbu C.Ammonia toxicityto the brain [J].Journal of Inherited Metabolic Disease,2012,36(4):595-612.
[43]Klejman A,WęgrzynowiczM,Szatmari E M,et al.Mechanisms of ammonia-induced cell death in rat cortical neurons:roles ofNMDAreceptors and glutathione[J].NeurochemistryInternational,2005,47(1-2):51-57.
[44] Brusilow S W.Hyperammonemic encephalopathy[J].Medicine,2002,81(3):240-249.
[45] Tsui T K N,Randall D J,Hanson L,et al.Dogmas and controversies in the handling of nitrogenous wastes:ammonia tolerance in the oriental weatherloach Misgurnus anguillicaudatus[J].JournalofExperimentalBiology,2004,207(12):1977-1983.
[46]Ip Y K,Leong MW F,Sim MY,et al.Chronic and acute ammoniatoxicity in mudskippers,Periophthalmodon schlosseri and Boleophthalmus boddaerti:brain ammonia and glutamine contents,and effects of methionine sulfoximine and MK801 [J].Journal of Experimental Biology,2005,208(10):1993-2004.
[47]Sinha A K,Giblen T,AbdElgawad H,et al.Regulation of amino acid metabolism as a defensive strategy in the brain of three freshwater teleosts in response to high environmental ammonia exposure[J].Aquatic Toxicology,2013,130-131(2):86-96.
[48]Pärt P,Wright P A and Wood C M.Urea and water permeability in dogfish(Squalus acanthias)gills[J].Comparative Biochemistry&Physiology Part A Molecular&Integrative Physiology,1998,119(1):117-123.
[49]Wilson J M,Iwata K,Iwama G K,et al.Inhibition of ammonia excretion and production in rainbow trout during severe alkaline exposure[J].Comparative Biochemistry&Physiology B Comparative Biochemistry,1998,121(1):99-109.
[50]Lim C B,ChewS F,Anderson P M,et al.Reduction in the rates of protein and amino acid catabolism to slow down the accumulation of endogenous ammonia:a strategy potentially adopted by mudskippers(Periophthalmodon schlosseri and Boleophthalmus boddaerti)during aerial exposure in constant darkness[J].Journal ofExperimental Biology,2001,204(9):1605-1614.
[51]Tsui T K,Randall D J,Chew S F,et al.Accumulation of ammonia in the body and NH3 volatilization from alkaline regions of the body surface during ammonia loading and exposure to air in the weather loach Misgurnus anguillicaudatus[J].J Exp Biol Journal of Experimental Biology,2002,205(5):651-659.
[52]ChewS F,Jin Y&Ip Y K.The loach Misgurnus anguillicaudatus reduces amino acid catabolism and accumulates alanine and glutamine during aerial exposure[J].2001,74(2):226-237.
[53]Wilson R W&Taylor E W.Transbranchial ammonia gradients and acid-base responses to high external ammonia concentration in rainbow trout(Oncorhynchus mykiss)acclimated todifferentsalinities[J].Journal ofExperimental Biology,1992,166(1):95-112.
[54]Randall D J,Wilson J M,Peng K W,et al.The mudskipper,Periophthalmodon schloesseri,actively transports NH4+against a concentration gradient[J].American Journal ofPhysiology,2000,277(6):1562-1567.
[55]Wilson J M,Randall DJ,DonowitzM,et al.Immunolocalization of ion-transport proteins to branchial epithelium mitochondria-rich cells in the mudskipper(Periophthalmodon schlosseri)[J].Journal ofExperimental Biology,2000,203(15):2297-2310.
[56]Liu H,Xie S,Zhu X,et al.Effects of dietary ascorbic acid supplementation on the growth performance,immune and stress response in juvenile Leiocassis longirostris,Günther exposed to ammonia[J].Aquaculture Research,2008,39(15):1628-1638.
[57] 陈秀梅.γ-氨基丁酸对建鲤生长、免疫和抗氨氮胁迫的影响[D].长春:吉林农业大学,2015.
[58]张艳亮.维生素E对云纹石斑鱼幼鱼生长、免疫及抗胁迫能力的影响[D].上海:上海海洋大学,2015.
[59]胡毅,黄云,文华,等.维生素C对青鱼幼鱼生长、免疫及抗氨氮胁迫能力的影响[J].水产学报,2013,37(4):565-573.
[60]罗娜,丁志丽,张易祥,等.饲料亚麻酸含量对日本沼虾生长、抗氧化能力、非特异性免疫性能及抗氨氮胁迫能力的影响[J].动物营养学报,2017,29(1):134-146.
[61]宋超,牛翠娟,陈欣然.壳聚糖对急性氨氮胁迫下中华鳖稚鳖非特异性免疫反应的影响[J].动物学报,2007,53(2):270-277.
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

