鱼类对饲料可消化糖的利用和代谢特征
鱼类对饲料可消化糖的利用和代谢特征
程开敏 李沛洋 郑石轩 朱学芝 马学坤 李新宇
(广东粤海饲料集团股份有限公司,广东湛江 524017)
自20世纪80年代以来,国际水产养殖总量以每年6%~12%的速率增长,目前已经提供超过一半的全球渔业产量[1]。根据相关统计数据,全球接近70%的水产养殖依赖于投喂商业饲料,因此水产动物营养与饲料科技的进步对水产养殖健康发展至关重要[2]。为了达到较高的产量和利润,主流商业配合饲料往往呈现高蛋白高能量的特征。近年来,膨化饲料因具有较好的物理性状和可消化率,已成为许多水产饲料的主流产品[3]。为达到理想的生产效率和膨化效果,目前膨化饲料的淀粉推荐水平约为20%[4]。
糖类是鱼类三大营养物质之一[5-6]。糖类作为非蛋白能量物质,有节省蛋白质的作用,并且在代谢过程中能够产生一定的有益代谢产物,饲料中保持适量的可消化糖(主要是淀粉)水平能够提高养殖对象的生长速度和饲料利用表现[7-8]。为了节省成本和减少蛋白质的浪费,商业饲料往往尽可能地提高非蛋白能(如可消化糖和脂肪)的使用比例。另一方面,不同食性的鱼类对饲料淀粉的利用率差异较大,草食性或者部分杂食性鱼类可以充分利用40%淀粉水平的饲料而不影响生长和健康[4,9],而肉食性鱼类饲料的淀粉水平一般在20%以下,个别品种甚至要求低于10%[3]。有研究表明,过量摄入糖类将影响鱼类生长、摄食和健康[10]。虽然近年来配合饲料技术发展迅速,但给鱼类投喂这些高能量高淀粉的商业配合饲料往往会导致一定的健康问题。因此,针对不同品种的鱼类,应该谨慎评估饲料的淀粉水平,以保证鱼类健康快速生长。
近年来,国外已有学者就鱼类对饲料可消化糖类的消化、吸收和利用进行了总结[11]。本研究在过去研究的基础上,总结了不同鱼类对糖类的代谢特征和常见的研究方法,并归纳了不同食性鱼类对饲料淀粉的利用效果,皆在为商业配合饲料开发提供理论指导依据。值得注意的是,广义糖类物质涵盖范围较广,本研究主要总结的是可消化糖类(如淀粉、葡萄糖等)在鱼类营养中的研究进展。
1 糖类
蛋白质、脂肪和糖类是鱼类饲料中的三大营养物质。糖类作为重要的能量来源,不仅价格低廉,还具有节省蛋白质、保护环境等作用。糖类的准确定义为:多羟基醛或多羟基酮以及水解后能够产生多羟基醛或多羟基酮的一类有机化合物[12]。糖类是自然界中分布极为广泛的一类有机化合物,大多数植物体糖含量可达干质量的80%。植物种子中的淀粉,根、茎、叶的纤维素,动物组织中的糖原、黏多糖,以及蜂蜜和水果中的葡萄糖、果糖等都是糖类。其中,淀粉(如小麦淀粉、木薯淀粉、玉米淀粉等)是鱼类配合饲料的主要可消化糖来源。
2 淀粉的消化和吸收
饲料淀粉的消化和吸收(葡萄糖形式)是动物利用可消化糖作为能量源的初始步骤。在肠道淀粉酶的作用下,多糖(如淀粉和糖原)被分解为单糖(葡萄糖)被肠道吸收。在哺乳动物中,淀粉的消化从口腔开始,在唾液淀粉酶的作用下被消化成麦芽糖或糊精[13]。但是,由于鱼类口腔中缺乏淀粉酶,该步骤在鱼类中并不重要。糊精和麦芽糖可被麦芽糖酶进一步水解成葡萄糖。在鱼类体内,淀粉酶主要由胰腺产生,并分泌到肠道和幽门盲囊中。例如,在黄尾鱼师(Seriolalalandi)的幽门盲囊和肠道中可检测到较高活性的α-淀粉酶[14]。值得注意的是,α-淀粉酶只可以水解淀粉内部的α-1,4-糖苷键,而不能水解α-1,6-糖苷键。大量研究已经证明,淀粉酶活性受鱼类食性的影响,草食性鱼类的淀粉酶活性往往高于肉食性鱼类,如鲤鱼和金鱼的消化道淀粉酶活性明显高于海鲷、鳗鱼和鳟鱼的相应酶活性[15]。同时,淀粉酶活性也受多种其他因素影响,如营养状态、温度和饲料成分等[3]。此外,葡萄糖作为一个极性物质不能直接穿透细胞膜,因此需要转运蛋白协助吸收。
鱼类对饲料淀粉的消化还受到不同淀粉源及其水平的影响,并且整体低于蛋白质和脂肪的消化率[3]。淀粉颗粒越小越有利于其消化。因此,糊化淀粉一般比生淀粉拥有更佳的消化率[3,16]。另外,淀粉原料中的直链淀粉与支链淀粉比例也会影响对淀粉的消化。一般认为,支链淀粉更容易被消化[3]。通常而言,糖类链越短,越有利于被鱼类消化吸收(葡萄糖>麦芽糖>淀粉),但不同品种略有差异。如团头鲂(Megalobramaamblycephala)对葡萄糖、麦芽糖和糊精拥有较高的消化率,其次为小麦淀粉和玉米淀粉,最差为纤维素[17]。由于鱼类淀粉酶分泌有限,往往会有一个最高的饲料淀粉可消化水平[18],如随着饲料淀粉水平从8%上升至17%,大西洋比目鱼对淀粉的消化率从84%降至53%[19]。对草鱼的研究也表明,其对淀粉的消化率随着饲料淀粉水平的上升而下降[20]。
3 葡萄糖转运
葡萄糖转运体存在于身体的各个组织细胞中,一般分为两类。一类是钠依赖的葡萄糖转运体(SGLT),以主动方式逆浓度梯度转运葡萄糖;另一类是易化扩散的葡萄糖转运体(GLUT),以易化扩散的方式顺浓度梯度转运葡萄糖,其转运过程不消耗能量。与哺乳动物一样,糖在鱼体消化道被分解成单糖后,通过肠道黏膜SGLT1被组织吸收。目前,对鱼类的不同葡萄糖转运体有一定的研究。GLUT1和GLUT3是一类广泛分布于众多组织器官中的葡萄糖转运体,其中个别鱼种的GLUT3在脑部表达较高[21]。GLUT2主要在肝脏、肠道和肾脏中表达较高[18,22-23]。GLUT4则主要在肌肉组织中表达,包括白肌、红肌和心肌[18,24],考虑到肌肉组织占比较大,该转运体对鱼体内糖稳态调节起到重要作用。GLUT4转运活性受限或者对相关激素调节不敏感是鱼类高糖不耐症的主要原因之一[25-26]。
4 葡萄糖的代谢
血液流经各组织时,葡萄糖被各组织吸收,一部分被直接氧化利用,另一部分被转变为糖原或脂肪。整体上,体内葡萄糖的去路可分为3条路径(见图1):①糖酵解(glycolysis)产生丙酮酸进入三羧酸循环彻底氧化,或进一步合成脂肪和乳酸;②戊糖磷酸途径(pentose phosphate pathway)代谢产生还原型辅酶Ⅱ(NADPH)和核糖-5-磷酸;③合成糖原,储存在肌肉和肝脏组织中。此外,动物体能将简单的非糖前体(如乳酸、甘油、生糖氨基酸等)转变为糖(葡萄糖或糖原),又称为糖异生。
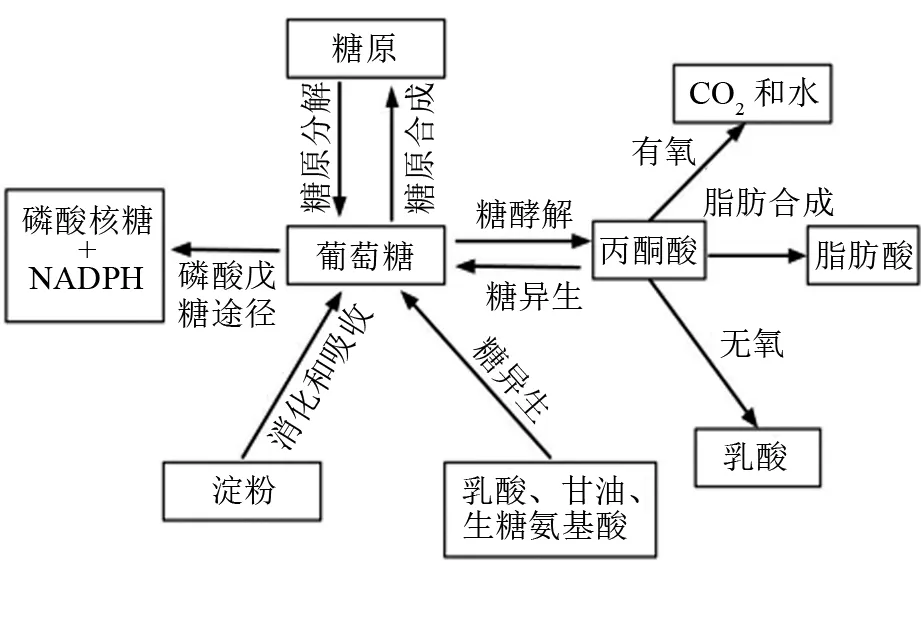
图1 动物体内糖类消化、吸收和代谢的基本途径
4.1 糖的降解和异生
糖酵解和糖异生是维持机体糖稳态的两条重要代谢通路。糖酵解是从葡萄糖开始分解生成丙酮酸的过程,全过程共有10步酶催化反应。该通路主要通过3个关键酶反应步骤进行调控:①己糖激酶(HK)参与的葡萄糖磷酸化,需要Mg2+作为辅助因子;②磷酸果糖激酶-1(PFK-1)参与的催化6-磷酸果糖生成1,6-二磷酸果糖;③丙酮酸激酶(PK)参与的催化磷酸烯醇式丙酮酸分子高能磷酸基团转移给ADP生成ATP,产生丙酮酸,需要Mg2+和K+参与,反应不可逆。己糖激酶目前已知有4种不同的型态,包括己糖激酶Ⅰ、己糖激酶Ⅱ、己糖激酶Ⅲ,以及与前三者差异较大的己糖激酶Ⅳ(又称为葡萄糖激酶,GK)。其中,GK拥有较高Km值,对血糖调节意义重大,其表达往往受血糖水平的影响[27]。糖酵解产生的丙酮酸可进一步被分解成乙酰辅酶A,然后进入三羧酸循环,产生更多的ATP。另一方面,在乳酸脱氢酶的作用下,丙酮酸也可能被无氧酵解为乳酸。在鱼类中,组织(尤其白肌)往往含有较高的乳酸脱氢酶活性[24],证明该途径也是鱼类葡萄糖代谢的主要路径之一。草食性鱼类能够通过提高糖酵解酶活性来适应饲料中较高的淀粉水平[28],但肉食性鱼类相关酶活性的调节能力有限,导致对饲料淀粉利用受限[29-31],如大黄鱼投喂过量的饲料淀粉反而会降低GK和PK的活性[32]。研究也表明,肉食性鱼类各个组织主要以氨基酸为能量来源,而非葡萄糖[33-34]。
在哺乳动物中,还存在一个乳酸循环(lactic acid cycle)。当肌肉收缩时(尤其是供氧不足时)通过糖酵解生成乳酸。肌肉内糖异生活性较低,所以乳酸通过细胞膜弥散进入血液后,再被肝脏组织摄入,在肝内异生为葡萄糖。然后,该葡萄糖释入血液后又可重新被肌肉利用,这就构成了一个循环(肌肉-肝脏-肌肉),此循环也称Cori循环。前文提到,大部分鱼类白肌能够产生大量乳酸,因此鱼类也可能存在这种循环,但相关研究仍然十分有限。
糖异生的七步反应是糖酵解中的逆反应,它们有相同的催化酶。另一方面,糖酵解中有三步不可逆反应,因此糖异生时必须绕过这三步反应。整体上,糖异生主要由以下4种酶控制反应:①丙酮酸羧化酶,可以催化二氧化碳固定在丙酮酸上,生成草酰乙酸;②磷酸烯醇丙酮酸羧激酶(PEPCK),催化草酰乙酸形成磷酸烯醇式丙酮酸和二氧化碳;③果糖-1,6-二磷酸酶(FBPase),催化1,6-二磷酸果糖和水生成6-磷酸果糖;④葡萄糖-6-磷酸酶,催化葡萄糖合成。有研究报道,体内糖异生是维持葡萄糖稳态的重要路径[35]。如在摄入足量淀粉的情况下,鲤鱼可通过减少糖异生活性,预防血糖过高[36]。但对于某些肉食性鱼类,它们缺乏这种调控机制,从而导致无法适应高糖饲料[9]。也有研究者发现,虹鳟糖异生活性不受饲料糖水平的影响[37-39]。
磷酸戊糖途径是葡萄糖氧化分解的另一种方式,具有多种生理意义:①为核酸的合成提供核糖;②生成大量的NADPH+H+,作为供氢体参与多种代谢反应;③通过磷酸戊糖途径中的转酮醇基及转醛醇基反应,促进糖在体内的转变;④NADPH可用作脂肪酸合成,并参与抗氧化反应。目前,该通路在鱼类中的研究相对较少。
4.2 糖原和脂肪合成
游离葡萄糖在糖原合酶的催化下与引物分子(未降解完全的糖原分子或糖原素)合成糖原。值得注意的是,游离的葡萄糖分子并不能直接作为糖原合酶的底物,需要在细胞内首先被激活为6-磷酸葡糖,再经磷酸葡糖变位酶催化异构化为1-磷酸葡糖。糖原合成能够暂时储存体内过多的葡萄糖,对维持血糖稳定意义重大。最近的研究表明,饲料可消化糖水平增加会引起部分鱼类肝脏糖原快速积累,但长期过度积累将导致肝脏损伤[40-42]。
如前文所述,糖酵解后产生丙酮酸可被进一步分解为乙酰辅酶A,而乙酰辅酶A是合成脂肪酸的重要物质。乙酰辅酶A与碳酸氢根、ATP反应,羧化生成丙二酸单酰辅酶A。该反应由乙酰辅酶A羧化酶(ACC)催化,是脂肪酸合成的限速步骤。乙酰辅酶A和丙二酸单酰辅酶A在脂肪合成酶的作用下,通过连续的酮还原酶、脱水酶以及烯脂酰ACP还原酶的作用,完成脂肪链的延长。磷酸戊糖途径产生的NADPH也参与了该反应,因此葡萄糖代谢对脂肪合成非常重要。对部分鱼类的研究结果也证明,高淀粉饲料提高了体内脂肪蓄积或组织脂肪合成相关基因的表达水平,证明鱼类可以通过调节脂肪合成适应高糖饲料[43-44]。
5 血糖和激素调节
尽管大部分鱼类的空腹(24 h以上)基础血糖水平差异不大,血糖浓度大多在3~7 mM(见表2)[28,43-44,52-71],但餐后或葡萄糖注射后的峰值水平差异较大,在5~40 mM[9]。血糖必须保持一定的水平才能维持体内各器官和组织的正常工作。胰岛素和胰高血糖素是调节血糖稳定的主要两种激素。胰岛素是降低血糖的激素,能够促进糖原、脂肪、蛋白质合成,并促进糖酵解。胰高血糖素具有很强的促进糖原分解和糖异生作用,能使血糖明显升高。鱼类血液的胰岛素含量大多在0.2~5.0 nmol/L,但个别餐后可能更高。Kamalam等[11]报道,胰岛素可刺激鱼类组织提高葡萄糖的摄入效率,通过激活相关通路,刺激糖酵解、糖原和脂肪合成,并抑制糖异生,从而达到血糖下降的目的。对于部分鱼类,血清胰岛素水平明显随饲料糖水平的提高而提高[45]。但对虹鳟的研究表明,胰岛素反而会抑制血糖清除速率[从(8.6±0.6)μmol·kg-1·min-1下降到(5.4±0.5)μmol·kg-1·min-1],从而证明某些肉食性鱼类胰岛素的作用可能与传统认知不同[46]。Navarro等[47]研究表明,鱼类胰岛素对血糖刺激不敏感,尤其是肉食性鱼类,胰岛素主要受游离氨基酸刺激而分泌。对虹鳟的研究表明,精氨酸注射能使血清胰岛素水平从12.5 ng/mL上升到76.8 ng/mL,并增加胰岛素和组织的结合效率[48]。对加州鲈的研究表明,精氨酸能够刺激胰岛素的分泌,并且效果稍好于葡萄糖的刺激效果[49]。胰高血糖素在鱼类中的作用基本与其在哺乳动物中的作用相似。对几种鱼类的研究表明,胰高血糖素能够提高糖原分解和糖异生的效率[9]。在对虹鳟的研究中发现,该激素通常在餐后或高血糖情况下被抑制[50]。此外,该激素分泌也受饲料氨基酸组成和环境因素的影响[51]。

表2 部分鱼类糖耐量试验结果
6 试验方法
6.1 糖耐试验
糖耐试验,也称葡萄糖耐量试验,是检测动物对葡萄糖利用的一种实验室方法,主要有注射和口服两种。在人类疾病诊断中,该试验有较好的统一标准,并且对患者的药物服用、饮食摄入、生理活动等都做了一定的约束。糖耐量最早用于诊断人类的糖尿病,其测定方法是在空腹状态下口服一定剂量(一般为1 670 mg/kg体质量)葡萄糖后,每隔一段时间测定血糖水平,对比血糖恢复到空腹的基础水平所需要的时间来确诊糖尿病。在鱼类研究中,糖耐量试验的给糖方式主要包括口服、静脉注射、腹腔注射和肌肉注射[72]。不同的方式具有各自优劣性,口服方式对试验动物的刺激小,能比较准确地反映鱼类对葡萄糖的耐受能力。注射方式敏感性高、重复性好、变异性小,但注射易使试验动物产生一定的应激而影响最后的血糖数值。不同于人类,鱼类糖耐量试验中的给糖量差异较大,为200~2 000 mg/kg不等。从表2可知,不同的给糖量显著影响糖耐量试验中的血糖浓度和高血糖持续时间,从而影响不同试验之间的相互比较与参考。在此建议,今后应确定一套规范的方法,规定糖耐量试验中的口服以及注射的葡萄糖量,并要详细规定对象鱼类的生理状态条件,以便比较不同种鱼类的糖利用率。
不同食性的鱼类对葡萄糖的耐受能力不同,一般来说,肉食性鱼类比杂食性和草食性鱼类对葡萄糖的耐受能力要低。有研究给青鱼和草鱼分别饲喂等剂量(1 670 mg/kg或420 mg/kg)葡萄糖后,两种鱼的血糖均有不同程度的升高,但相同时间内草鱼的血糖含量比青鱼低,血糖恢复到空腹水平的时间也比青鱼短[73]。另一个试验中,被注射等量葡萄糖(300 mg/kg)后,罗非鱼的葡萄糖耐受能力最强,卵形鲳鲹次之,军曹鱼最弱[74]。此外,鱼的营养状态也可能影响最后的试验效果。用糊精含量分别为5%、25%、50%的3种饲料饲养异育银鲫,禁食24 h后,再口服1 670 mg/kg的葡萄糖,各组鱼血糖迅速升高,均在3 h后出现血糖峰值,但5%糊精组和25%糊精组在5 h后血糖即恢复到空腹水平,50%糊精组7 h后才恢复到空腹水平[75]。对罗非鱼(Oreochromisniloticus)的研究结果也表明,给养殖鱼类投喂不同的饲料糖水平,以及给糖量不同都将影响最后的血糖数值,详见表2。
6.2 投喂试验
此外,可以通过配制含有不同淀粉水平的饲料,投喂养殖鱼类数周,观察其生长、饲料利用效率、血糖以及其他指标来评价鱼类对糖的利用能力。试验饲料应符合如下要求:①除被试验的成分(淀粉)外,试验饲料的所有其他组分尽可能完全一致,且营养全面;②试验饲料的化学物理性状应符合试验动物的摄食习性要求;③具有良好的水中稳定性,以减少营养物质的溶失,提高营养物质摄入量的估计精度。
由于鱼类不能利用大量糖作为能量(糖酵解受限),因此过高的淀粉摄入往往以糖原和脂肪形式储存在体内。但肝脏是主要代谢器官,过量的糖原和脂肪积累将导致肝脏功能减退。因此,探明不同鱼类的肝脏对高糖饲料的反应特征具有十分重要的意义。几乎所有鱼类的肝脏体积都会随着饲料淀粉水平的提高增大,但形式有所不同。例如,对草鱼的研究表明,其肝脏质量和脂肪水平随着饲料糖水平提高而增加,但糖原含量变化不明显[76]。还有一些鱼类,如虹鳟的脂肪和糖原都能够在肝脏中有效积累。但很多肉食性鱼类倾向于将过量葡萄糖合成糖原而非脂肪,且糖原主要储存于肝脏中。对石斑鱼的研究表明,肝脏体积和肝糖原含量随着饲料淀粉水平提高而增加,且肝脏脂肪呈现下降趋势。对加州鲈的研究也表明,其肝脏糖原的合成速率远高于脂肪的合成速率[40]。研究发现,肉食性鱼类的肝脏往往含有较高的糖原,如欧洲海鲈肝脏糖原含量为105 mg/kg[27],金鲳鱼(Trachinotusovatus)为287 mg/kg[77],石斑鱼(Epinephelusakaara)为227 mg/kg[78]。由此可见,肝脏糖原过度积累是许多养殖肉食性鱼类后期生长受限和健康问题频发的主要原因。值得注意的是,不同鱼类的肝脏成分差异巨大,这导致很难形成一个专门的诊断标准来确定鱼类肝脏代谢疾病。因此,未来应根据不同鱼类自身的生理特点来建立不同标准诊断依据。此外,不同养殖试验的血糖结果差异较大,这是因为大部分试验主要以空腹血糖(饥饿24 h后)为指标。因此建议,养殖试验和糖耐试验应相互配合佐证,以得到更明确的试验结果。
7 结论和展望
饲料可消化糖对鱼类生长和代谢影响的研究已较全面,但在许多其他营养物质的研究中,却一直被当作能量填充物,其对鱼类生理和代谢的影响一直被低估。如在对一种肉食性鱼类的蛋白质需求量定量试验中,研究者配制了7组等能但不等氮的饲料,饲料蛋白质水平由25%上升至55%,同时降低饲料淀粉水平,由55%降至25%[79]。尽管该试验未评价健康指标,但低蛋白组鱼的摄食量只有中蛋白组的60%左右。类似的研究也发现,幼鱼的肝脏大小、肝糖原含量和摄食量受饲料淀粉水平影响较大[80]。因此,很多试验可能受淀粉水平的干扰,导致结果误差较大。在未来的研究和生产中,应该更加注重淀粉水平的合理设置。此外,由于水产养殖对象的多样性,不同种类的葡萄糖代谢模式存在较大差异,如肉食性鱼类往往倾向于将过量葡萄糖以糖原形式储存在肝脏中,而有些鱼类则既能合成糖原也能合成脂肪,在研究时应根据种类制定相应的研究方法。此外,虽然糖耐量试验是了解鱼类对糖类利用的重要研究手段,但目前还没有统一的试验标准,导致结果参考意义不强。建议将来在统一方法标准的基础上,重点研究不同种类鱼类的葡萄糖代谢特征及调控方法。
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

