小球藻纯种室内模拟培养初探
小球藻纯种室内模拟培养初探
王 舒1肖 艳2,3李 哲2,3张利萍1郭劲松2,3
(1.重庆大学城市建设与环境工程学院,重庆 400044; 2.中国科学院重庆绿色智能技术研究院,重庆 400714; 3.中国科学院水库水环境重点实验室,重庆 400714)
摘要:实验以小球藻为藻种,构建室内模拟培养装置,在选定的一组优化的光照、温度和营养盐浓度条件下,采用间歇培养+连续培养的方式对其进行单种群培养,模拟藻类生物量积累的过程。将培养期划分为5个阶段,通过分析各阶段的光合荧光参数以及藻细胞内C、N、P含量,初探生物量积累过程中藻生理参数的变化特征,为研究水华的发生、维持和消退提供一定的参考。结果显示:调整期,藻生长不受生境光热、营养盐限制,小球藻光合活性较强; 对数生长期,藻类开始出现光抑制,热耗散增加,胞内N、P含量及N/P值较高; 对数生长期和稳定期,藻同时受光抑制和营养盐抑制,N和P含量、N/P值均下降; 连续培养期,营养盐限制得到缓解,小球藻光合活性开始升高,且藻细胞对N、P营养物吸收能力增强。监控藻类生物量积累过程中细胞内氮磷下降的“拐点”和细胞内元素比例变化可为预测水华的消退提供一定的参考依据。
关键词:小球藻; 生物量积累; 生理特征; 水华
水华现象是近年来我国水体生态学研究领域的热点。水华是指当水体出现富营养状况,并且在利于藻类生长和聚集的光强、温度以及气候等环境条件下,水体藻类大量繁殖或聚集并达到一定浓度的现象[1]。从单种群生长的角度,水华表现为优势藻在生境中最大化生长以实现生物量积累。普遍认为水华形成的诱因是生境条件改变刺激优势藻生长。如今已有大量[2—5]针对不同生境界因子如光照、温度和CO2浓度等对藻类生长影响的研究。然而水华是否暴发,其高生物量是否在一定时期内维持,这与藻类自身对生境条件改变所做出的生理响应也有一定的关联。
目前关于藻类生长对生境变化的响应机制研究主要有室内模拟和野外原位实验两种手段。室内藻类培养大多采取光照培养箱,通过侧面光照系统和温控装置对藻类生长进行观测,主要用于藻类种群生物量累积等方面的研究,但对于模拟水体光强垂直单向衰弱以及水体紊流扰动等对藻类的影响存在一定的局限性。野外原位实验极易受到气候变化的影响,难以通过独立控制单一因子,定量分析不同生境要素下藻类生长响应机制。
因此,为进一步明晰水华形成过程中藻类细胞生理的调整特征,研究设计了模拟室内试验装置,选取小球藻作藻种,采用间歇培养+连续培养的方式对其进行单种群培养,模拟藻生物量积累的过程,将培养期划分为间歇1期(1—3d)、间歇2期(4—8d)、间歇3期(9—14d)、稀释率0.01/d期(15—24d)、稀释率0.03/d期(25—36d)5个阶段,通过对各阶段叶绿素荧光参数以及藻细胞内C、N、P含量的分析,初探生物量积累过程中藻类细胞的生理参数变化特征,为研究水华的形成、维持和消退提供一定的参考依据。
1 材料与方法
1.1 藻类生物量积累室内模拟装置的构建
本文提出一种可模拟光照在自然水体中垂直分布特性、可在线监测或控制其他实验参数的藻类培养装置。模拟装置的尺寸为40 cm×80 cm× 50 cm(长×宽×高),包括培养液供给系统、培养箱供气系统、培养箱、培养箱顶部光源阵列与控制系统、在线监测系统、培养液出流与取样装置、外侧控温系统等。其结构如图1—4所示,具有以下突出特点:(1)光源均匀置于培养箱顶部,通过调节启闭灯管的数量和单根灯管的功率来控制入射的光照强度。光照入射方式同天然水体相同,可以很好的模拟天然水体中光照单向传递的现象。(2)培养箱可通过出水口的调节,采取不同水深的水样,实现对藻类生长和藻类垂向运动的研究。(3)培养箱内置水下光量子仪,可精确测量不同水深下光照强度的变化特征。(4)培养箱的水浴温控装置可以调节不同水层的水温,模拟天然水体中水温分层的特征。(5)培养箱系统各组件可拆卸,便于清洁和灭菌。(6)通过在线探头,可以对培养箱内藻类生长过程进行精确监控,并通过无纸记录仪自动记录。(7)培养箱可设置间歇运行、连续运行、半连续运行等多重运行模式,通过光照调节、水温调节、培养液浓度调节等,可模拟不同环境对藻类生长的影响。其中:1.PVC板材箱体; 2.透明有机玻璃顶板; 3.接种孔; 4.在线监测探头安装孔; 5.水下光量子仪测量孔; 6.供气干管; 7.光源阵列; 8.常闭的承插式观察孔; 9.温控装置; 10.出样口; 11.曝气支管; 12.曝气头; 13.曝气管槽; 14.培养液进样管;15.培养液进样孔; 16.水下光量子探头固定平台;17.垂直导轨; 18.温控材料; 19.PLC控制单元; 20.培养液进样系统; 21.蠕动泵; 22.光量子仪探头;23.可拆卸连杆; 24.水下光量子仪光缆; 25.气泵;26.流量调节阀; 27.流量计; 28.空气过滤器; 29.在线监测探头; 30.探头PLC控制单元。
1.2 实验材料
藻种及培养 小球藻(Chlorella sp.FACHB-8)购于中国科学院淡水藻种库(FACHB-collection)。以BG11为基础培养基进行常规培养,培养温度(25±1)℃,光照强度25 μmol/(m2·s),光周期12h︰12h。
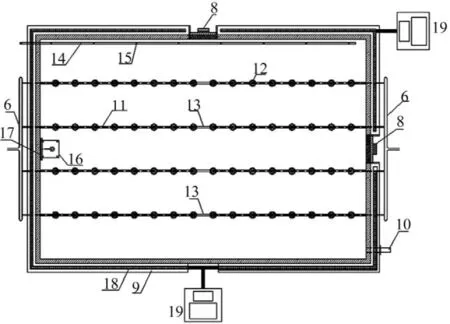
图 1 模拟装置顶部示意图

图 2 模拟装置底部示意图

图 3 模拟装置A-A剖面图

图 4 模拟装置B-B剖面图
藻液的制备 藻种在使用前先饥饿培养1周,取10 mL藻种于离心管中,以4500 r/min离心15min,弃上清液,加入15 mg/L NaHCO3溶液,用于除去表面吸附的多余的营养盐,再次离心15min,弃上清,重复2次,藻种的初始密度为1.0×104左右 。从而获得将被接种于模拟装置的藻液。
1.3 模拟装置的运行
实验通过对装置的稀释率调节来实现室内模拟藻类生物量积累。当稀释率低于藻类生长速率时,藻类可利用营养物质再次进行生物量的累积,从而达到该生境下的最大生物量值。稀释率是指培养液在模拟装置内平均停留时间的倒数。计算公式如下:

式中,D(/d)、F(L/d)、V(L)分别表示稀释速率、培养液输入流量、藻液体积。
在使用之前先将模拟装置内部清洗并紫外灭菌消毒,然后通过蠕动泵将超纯水注入,打开曝气装置,将模拟装置满负荷运行3—5d,排水,待用。将灭菌后的培养液通过蠕动泵注入模拟装置内,直至液面上升到20 cm处;培养液的供给管路置于箱内底部的一侧,沿培养管均匀设置若干小孔,培养液经过高温灭菌后通过密封的硅胶管路由蠕动泵抽入培养箱内。接着通过接种孔将培养至对数生长期的藻液接入培养箱内,打开曝气装置,使培养箱内藻液混合均匀;在实验中使用的气体为空气,由空气泵通过流量调节阀,经空气过滤器过滤后,由与箱体底部的曝气砂头通气支管通入培养箱内,气体的供给一方面用于培养箱内水体搅拌,维持水体一定的紊流扰动,另一方面用于补给藻类生长过程中所需的碳源,亦可调节箱内水体酸碱度,本实验设置的通气速率为0.6 L/min。通过顶部光源阵列系统和侧面温控系统将培养箱的光照强度和温度分别设定为100 μmol/(m2·s)和25℃,每天8:00开启,20:00关闭,光周期为12h︰12h。
先通过间歇运行阶段,使藻类在特定的生境下历经调整期和对数期,随着营养物的消耗的加剧,最终藻类生物量达到一个稳定值,进入稳定期。此时模拟装置开启连续培养运行阶段,其他条件保持不变,以相同的流量不断的加入和放出培养液,培养液的放出由箱右侧的出样口进行,最初稀释速率设置为0.01/d,运行一段时间后,藻类生物量再次达到一个稳定值进入稳定期,此时再将稀释速率调为0.03/d运行一段时间。在培养期间,取样时间为每天的9:00—10:00。按照实验计划进行指标测试。
1.4 监测指标及方法
在线监测指标 在线监测指标主要有pH、ORP和DO,通过无纸记录仪每隔30min记录一次数据。通过检测这3个指标判断内部环境是否在小球藻生长的适宜范围内,以便能及时进行调整。
光合荧光动力学参数指标 实验采用由德国Walz公司生产的PHYTO-PAM,它的特点是分析快速、灵敏和非破坏性。取水样2 mL于样品杯中,放在黑暗环境中暗适应15min后,放入PHYTOPAM仪器中,分别测出最小荧光F0、最大荧光Fm,其中(Fm-F0)为可变荧光Fv,Fv/Fm即为PSⅡ(光系统Ⅱ)的最大光量子产量,反映了藻类的潜在最大光合效率[6]。水样不经过暗适应,PHYTO-PAM测定其Fm′、Fs,通过公式1、公式2可得ΦPSII、NPQ。计算公式如下:

式中:Fm′表示光适应状态下所有反应活性中心都关闭并且所有的非光化学过程都处于最优态的荧光产量; Fs表示稳态荧光产量; ΦPSⅡ表示PSⅡ光化学能量转化的有效量子产量; NPQ表示非光化学淬灭,通常作为光适应状态下PSⅡ的天线系统将过量的光能耗散为热能的监测指标。
小球藻细胞内叶绿素的测定 取4 mL藻液于5 mL离心管中,在温度25℃、转速6000 r/min下离心5min,吸掉上清液,向所得沉淀中加入4 mL 95%乙醇,于4℃避光提取24h后离心(6000 r/min,4℃,5min)并取上清液,于649 nm和665 nm波长处,以95%乙醇为参比,测定吸光度,叶绿素a计算公式为Chl.a=13.7A665-5.76A649,单位μg/L[7]。
小球藻细胞内P、C、N的测定 藻P(CellP)的测定。将直径为25 mm、孔径为0.45 μm 的GF/F膜在45℃下灼烧4h,在干燥器中冷却置室温后,过滤水样收集藻细胞,用蒸馏水通过滤膜2—3次去除GF/F膜上的营养盐。将过滤后含有藻细胞的滤膜置于50 mL具塞比色管中,加蒸馏水至25 mL,将膜淹没其中后,加入5%过硫酸钾溶液4 mL。高压锅120℃灭菌30min。冷却至室温,加蒸馏水至50 mL。使用钼蓝法测定磷酸盐含量。
藻C(CellC)、藻N(CellN)的测定。将直径为25 mm、孔径为0.45 μm的GF/F膜在45℃下灼烧4h,在干燥器中冷却置室温后,过滤水样收集藻细胞,用蒸馏水通过滤膜2—3次去除GF/F膜上的营养盐。将过滤后含有藻细胞的滤膜于65℃下烘24h后于元素分析仪测定藻细胞内C、N含量。
2 结果
目前关于水华的评判标准大多采用的是水体中Chl.a的浓度大于10 μg/L,生物量大于2×104cell/ L[8]这一指标,本论文中水华判断亦采用此标准。图 5为装置内小球藻的生长曲线,根据模拟装置内小球藻的生长曲线以及装置的不同运行模式,本文将小球藻的培养期划分为5个阶段:间歇1期,1—3d,该时期为小球藻的调整期; 间歇2期,4—8d,该时期为小球藻的前指数生长时期; 间歇3期,9—14d,该时期为小球藻后指数生长时期和稳定期; 稀释率0.01/d期,15—24d,该时期为装置以稀释率为0.01/d运行时期; 25—36d,该时期为装置以稀释率为0.03/d运行时期。从各阶段叶绿素荧光参数和藻C、N、P含量两个方面来探讨小球藻生物量积累过程中的生理响应。

图 5 装置内小球藻生长曲线
2.1 模拟装置内在线pH、ORP及DO的监控
使用在线pH和ORP控制探头可实现对培养箱内藻类生长过程的精确监控。水体pH是一个重要的生态参量,主要从两个方面来影响微藻的生长:一方面改变环境的酸碱度,较强的酸性或碱性均会对藻细胞产生伤害; 另一方面通过影响水体碳酸盐的平衡以及不同形态无机碳的分配关系来影响藻类的生长。不同的藻种有不同的pH适应范围:鱼腥藻的适宜pH范围为8.0—9.0,微囊藻的pH适宜范围为9.0左右,来莱茵衣藻的最适pH范围为7.0左右[9]。氧化还原电位(ORP)也是广泛用于检测水体水质的重要指标,水体中ORP较低时表明还原性物质或有机污染物含量高,不利于藻类的生长,但过高的ORP对生物的生长也不利。一般好氧微生物在氧化还原电位为+100 mV以上均可生长,但最适值为+300—+400 mV; 厌氧性微生物只能在较低于+100 mV以下生长。表1为模拟装置内在线监测结果。
藻类在生长过程中通过光合作用吸收CO2释放O2,水体pH含量会升高,同时藻类产生的还原性产物以及水体中溶解氧的降低也会使ORP降低。本实验的目的是在模拟装置运行过程中小球藻的生物量达到最大形成水华,故而当水体中pH或ORP过高或过低时,需通过改变曝气量使得pH和ORP维持在小球藻适宜生长的范围内。有研究表明小球藻的适宜酸碱度为7.0—8.0[10]。模拟装置运行过程中pH的变幅为7.535—7.648,ORP的变幅为290—430 mV,均在小球藻适宜生长范围内。
2.2 模拟装置内小球藻光合荧光参数的变化
藻类吸收的光能的用途有三个途径:光合作用、热耗散以及荧光。光合荧光动力学参数反应了小球藻的光合作用的过程和生境要素对光合能力的影响。Fv/Fm在正常生理状态下,它是一个稳定的值,藻类约为0.65[11],当藻类受到环境胁迫时其值开始显著下降,它常用作研究环境胁迫对光合作用影响的重要指标。ФPSⅡ表示任一光照下的PSⅡ实际光合能量。有研究表明[12,13],当藻类受到营养盐限制时,光合作用能力会下降。NPQ是一种重要的“下游调节”机理,当外界条件发生变化时,通过NPQ的调节可以使光化学淬灭保持恒定,但NPQ的调节是有限的[14]。它通常作为光适应状态下PSⅡ的天线系统将过量的光能耗散为热能的监测指标。
图 6—9分别为培养期间5个阶段Chl.a含量、Fv/Fm、ФPSⅡ及NPQ的变化。

表 1 模拟装置内在线监测指标Tab.1 Online indicators during chemist at running
由图 7可知,整个模拟装置运行期间,小球藻的光合活性Fv/Fm总体变化幅度不大,但在间歇2期和间歇3期较其他培养阶段低。图 8可知,模拟装置运行过程中,间歇1期ФPSⅡ均值高于其他培养时期,间歇2期和间歇3期较其他培养阶段低。图 9可知,模拟装置运行过程中,NPQ均值处于逐渐上升趋势。

图 6 不同培养期小球藻Chl.a变化

图 7 不同培养期小球藻Fv/Fm变化

图 8 不同培养期小球藻ФPSⅡ变化
叶绿素a能反映水体中小球藻的生物量,模拟装置运行过程中在间歇1期时,Chl.a均值(图 6)为(6.600±2.335)μg/L,处于较低水平,该时期藻类处于适应新环境的调整期; 光合活性Fv/Fm和PSⅡ电子传递的实际量子产量ФPSⅡ较高,均值分别为(0.485±0.035)和(0.412±0.010),说明此时小球藻的光合能力较高,光能被吸收利用转化为化学能的效率较高; 同时NPQ均值为(0.012±0.010),为模拟装置运行期间最低值(图 6),说明热耗散较低,多余的激发能较少,绝大部分被吸收的光能都用于了光合作用。

图 9 不同培养期小球藻NPQ变化
间歇2期,Chl.a均值为(31.500±06.450)μg/L,较间歇1时期有了较大的提高,表示小球藻在历经了短暂的调整期后,细胞大量繁殖迅速进入对数生长期; 随着培养箱内小球藻密度的增大,水体的透光性减弱,藻类受到光抑制现象,光系统II反应中心P680不能得到有效还原,供体侧P680+累积,光系统II到光系统I的电子传递链受阻,ФPSⅡ均值为(0.299±0.098),较间歇1期降低; 随着光合作用的降低,小球藻通过调节自身光保护机制,通过非光化学淬灭进行热耗散,NPQ较高,在电子转移和热耗散的综合作用下,光合活性Fv/Fm均值为(0.460± 0.030),也较间歇1期低。
间歇3期,外界培养液的浓度开始降低,小球藻同时消耗细胞內源储存营养物质继续分裂增殖,培养箱内的营养物质逐渐成为小球藻生长繁殖的限制因子,藻类达到稳定期,Chl.a均值为(48.700± 3.716)μg/L,较间歇2期高,这段时期为对数生长后期至稳定初期; 藻类发生光合作用时,电子经过光系统II传至光系统I,再传递给最终受体NADP+,当藻受到营养限制时,部分电子还会通过Mehler等[15]反应再次回到PSI,从而产生热耗散,使得ФPSⅡ降低为(0.293±0.018); 同时NPQ增加,均值为(0.026± 0.001); 在电子转移和热耗散的综合作用下,Fv/Fm为(0.462±0.008),较间歇1期低,与间歇2期无显著差异。
稀释率为0.01/d期。此时的模拟装置开始进行连续培养,新鲜的培养液以稀释率0.01/d进入培养箱内,小球藻生物量继续累积,说明稀释率小于藻类的生长速率,此时Chl.a均值为(64.700±0.256)μg/L,为5个阶段最大值; Fv/Fm与ФPSⅡ均值分别为(0.479±0.0176)和(0.346±0.003),较间歇3期升高; 该时期藻类几乎不受到光抑制现象,光能绝大部分用于光合作用,热耗散较低,故NPQ均值较低,为(0.024±0.003)。
稀释率为0.03/d期,培养液以0.03/d稀释速度进入装置,藻类开始被冲出培养箱,稀释率大于藻类的生长速率,Chl.a均值较0.01/d有所降低,为(54.700±5.517)μg/L; 由于该时期藻类亦不受光抑制,光和活性Fv/Fm、ФPSⅡ与NPQ的均值分别为(0.473±0.009)、(0.326±0.039)和(0.023±0.002),较稀释率0.01/d时期无显著差异。
有室内实验探究环境变化对蛋白核小球藻和铜绿微囊藻光合作用的影响时,藻类的光合作用曲线趋势与本实验一致[16,17],当藻类受到光照、温度或营养盐限制时,光系统II均会遭到破坏,光合反应活动中心类囊体膜上电子传递速率降低,导致实际量子产量ФPSⅡ也降低,同时细胞的ATP合成受阻,在光合作用下降的同时,藻类为了避免过多能量损伤细胞,会启动自我保护机制,将过多的能量以热耗散的形式降低,NPQ值增高。
2.3 模拟装置内小球藻细胞内C、N、P的变化
C、N、P是藻类的主要组成元素。C是细胞的骨架元素,也是构成藻类细胞内叶绿素a和碳水化合物的主要组成元素。不少国内外学者研究表明[18,19]藻细胞内C与叶绿素a之间存在显著的正相关关系。N和P是生物体必须的基本元素,N的主要去处是合成藻类蛋白质以及一系列参与催化作用的酶,P是核酸、生物膜和ATP等大分子物质的重要组成成分,C、N、P对藻类的光合作用、呼吸作用和酶调节等方面均起重要作用。在小球藻培养过程中,模拟装置内小球藻细胞C、N、P的变化如表 2所示。
从表 2可以看出,模拟装置运行过程中,细胞碳的吸收总体趋势是上升的,这是由于随着细胞的分裂增殖,Chl.a以及碳水化合物等大分子物质合成需求较高,故而对C的需求也较高。

表 2 模拟装置内小球藻细胞内C、N、P的变化Tab.2 Values of CellC,CellN,CellP of Chlorella during chemostat running
细胞N、P的变化趋势与细胞C有一定的差异。Ketchum[20]在研究硅藻对水体中N、P营养物质的吸收时发现藻细胞内普遍存在“营养库”,即在合适条件下可过量储存某些营养元素,当环境中营养物浓度较低时,过量积累在藻细胞内的营养物质可以维持藻类继续分裂增殖,缓解藻类种群数量因外界环境营养物的缺乏而产生较大动荡。在本实验中小球藻在饥饿培养后历经间歇1期的调整期,到间歇2期前对数增长期时,细胞内N、P含量迅速升高,这是由于在此期间Chl.a含量较低,营养相对较为充分,藻细胞快速吸收并存储过量的N、P。到了间歇3期,由于藻生物量的不断增长,此时期的Chl.a均值为间歇培养期中最大值,水体中营养物的浓度不能充分维持小球藻生长,藻细胞的生长开始受到抑制,细胞内N和P的含量,这时藻开始消耗细胞内存储的N、P,故该时期细胞内N、P含量开始降低,此期间胞内N、P含量达到最小值(图10)。Janse等[21]研究表明藻类对N、P的吸收速率与细胞内N、P累积量有关,细胞内N、P含量越低,吸收速率越大。本文中稀释率0.01/d期,模拟装置开启连续运行,新培养液的流入,营养盐限制得到缓解,藻细胞又开始吸收储存N、P营养物,细胞内N、P含量较间歇3期大幅上升,但略低于间歇2期,Chl.a浓度也小幅度上升,达到5个时期的最大值。稀释率0.03/d,Chl.a值最终维持在45 µg/L左右,藻内N、P含量但与间歇3期,与稀释率0.01/d期相差不大。
培养期间小球藻细胞内CellN/CellP变化范围在6—23。Klausmeier等[22]人指出藻类在营养盐充裕条件下达到最大生长速率时细胞内CellN/CellP为最优N/P,当藻类受光照或营养盐等限制时,该值下降。模拟装置运行期间,间歇2期小球藻的生长速率达到最大值,该时期的N/P为小球藻在该生境下能达到的最优氮磷比,为22.77; 间歇3期,此时的Chl.a浓度为间歇培养期中 最大值,藻类生长受到营养盐限制时,细胞为了维持生长,开始消耗內源氮磷营养物质,而在营养盐受限的条件下,胞内N比P消耗快,CellN/CellP下降,这与国外许多研究的结果是一致的[23,24]。到了稀释率0.01/d期,新培养液的流入,营养盐得到了补充,藻细胞内N/P比上升,Chl.a浓度小幅度上升。0.03/d期是chla浓度略低于0.01/d期,N/P比与0.01/d期相差不大 ,远高于间歇3期。

图 10 培养期间CellN/CellP变化
综上可以发现,在藻生物量积累过程中,Chl.a浓度不断增大,水体中营养盐的含量逐渐降低,以至不能充分维持藻细胞的增长,藻会开始通过消耗内源存储的营养盐来维持期生长繁殖,此时藻类细胞内N、P含量和N/P比迅速降低。然而,细胞內源物质也消耗殆尽时,在没有外源营养盐加入的情况下持续一段时间,藻细胞生长进入衰亡期。也就是说,在藻类快要进入负增长期前,细胞内N、P含量和N/P持续下降,在降到某一个值时,我们把这个值处称为拐点,营养盐严重的限制了藻的生长,藻细胞生长进入衰亡期。
野外藻类水华的形成是由适宜的光照、温度以及水体中充裕的营养盐等原因造成,随着藻类大量生长繁殖,水体中营养盐的含量逐渐降低,当藻类细胞内氮磷等营养元素开始降低时,说明此时水体的营养盐含量已经无法维持藻类的生长,藻类需通过消耗细胞内储存的內源营养物质维持其生长繁殖,当细胞內源物质也消耗殆尽时,水体水华开始消退。因此监控藻类生物量富集过程中细胞内氮磷下降的“拐点”和细胞内元素比例变化可为预测水华消退的提供一定的参考依据。
3 结论
(1)调整期,藻生长不受生境光热、营养盐限制,小球藻光合活性较强; 对数生长前期,藻类开始受到光抑制现象,光合活性下降,热耗散增加,同时藻进行胞内N、P储存,胞内N、P、N/P较高; 对数生长后期和稳定期,水体中营养盐不足以维持藻生长,藻开始消耗胞内营养物质,N、P、N/P均下降,藻同时受光抑制和营养盐抑制; 连续培养期时,稀释率为0.01/d时细胞丰度最大,营养盐限制得到缓解,小球藻光合活性又开始升高,同时藻细胞对N、P营养物吸收能力增强。(2)在小球藻生物量积累过程中,生境资源随着生物量的增大而不断减少,当光热或营养物条件受限时,藻类光合活性下降,细胞内N、P含量亦协同发生变化。因此,监控藻类生物量积累过程中氮磷下降的“拐点”和细胞内元素比例变化可为预测水华消退提供一定的参考依据。(3)为进一步探索水华的形成、消退和维持机制,可多选取藻种,通过模拟装置设置不同的生境梯度进行藻生物量积累的过程模拟。
参 考 文 献:
[1]Zheng J J,Zhong C H,Deng C G.Discussion on definition of algal bloom[J].Water Resources Protection,2006,22(5):45—47[郑建军,钟成华,邓春光.试论水华的定义.水资源保护.2006,22(5):45—47]
[2]Wang J,Qiu L P,Meng S L,et al.Effects of temperature on growth and competition of Chlorella vulgarisris and Anabaena sp.strain PCC[J].Acta Hydrobiologica Sincia,2014,38(6):1127—1132[王菁,裘丽萍,孟顺龙,等.温度对普通小球藻和鱼腥藻生长竞争的影响.水生生物学报.2014,38(6):1127—1132]
[3]Sheng D S.Study on limiting factors of water eutrophication of the network of rivers in plain[J].Journal of Zhejiang University(Agric.& Life Sci.),2002,28(1):94—97[沈东升.平原水网水体富营养化的限制因子研究.浙江大学学报(农业与生命科学版).2002,28(1):94—97]
[4]Wang J,Wei X H,Yao W Z,et al.Relationship between chlorophyll a content and TN and TP concentrations in water bodies of south Taihu Lake[J].Journal of Zhengjiang University(Nature Science),2011,30(3):190—193[王俊,韦肖杭,姚伟忠,等.南太湖水体叶绿素a含量与氮磷浓度的关系.浙江海洋学院学报(自然科学版).2011,30(3):190—193]
[5]Li N,Bi Y H,Gao D W,et al.Effects of elevated CO2concentration on growth of Microcystis aeruginosa[J].Acta Hydrobiologica Sinica,2011,35(4):698—702[李娜,毕永红,高大文,等.大气CO2浓度变化对铜绿微囊藻生长的影响.水生生物学报,2011,35(4):698—702]
[6]Zhang M,Kong F,Wu X,et al.Different photochemical responses of phytoplankters from the large shallow Taihu Lake of subtropical China in relation to light and mixing[J].Hydrobiologia,2008,603(1):267—278
[7]Wintermans J F G M,De Mots A.Spectrophotometric characteristics of chlorophylls a and b and their pheophytins in ethanol[J].Biochimica et Biophysica Acta,1965,109(2):448—453
[8]Brookes J D,Ganf G G,Oliver R L.Heterogeneity of cyanobacterial gas-vesicle volume and metabolic activity[J].Journal of Plankton Research,2000,22(8):1579—1589
[9]Xu H,Liu Z P,Yuan L,et al.Effect of pH on growth of several freshwater algae[J].Environmental Science & Technology,2009,32(1):27—30[许海,刘兆普,袁兰,等.pH对几种淡水藻类生长的影响.环境科学与技术,2009,32(1):27—30]
[10]Liu J H,Yang H S,Wang H.Combined effects of temperature,salinity and pH on the specific growth rate of Chlorella[J].Acta Hydribiologica Sinica,2014,38(3):446—451[刘加慧,杨洪帅,王辉.温度、盐度和pH对小球藻生长率的联合效应.水生生物学报,2014,38(3):446—451]
[11]Kolber Z,Zehr J,Falkowski P.Effects of growth irradiance and nitrogen limitation on photosynthetic energyconversion in photosystem-II[J].Plant Physiology,1988,88(3):923—929
[12]Malta E J,Ferreira D G,Geider R J,et al.Nitrogen load and irradiance affect morphology,photosynthesis and growth of Caulerpa prolifera(Bryopsidales:Chlorophyta)[J].Marine Ecology Process Series,2005,298(1):101—114
[13]Qi H J,Wang J T,Wang Z Y.A Comparative study of the sensitivity of Fv/Fmto phosphorus limitation on four marine algae[J].Journal of Ocean University of China,2013,12(1):77—84
[14]Fu X,Han B P,Han Z G.Algal Photosynthesis:Mechanisms and Models[M].Beijing Science Press.2003,54—68[付翔,韩博平,韩志国.藻类光合作用机理与模型.北京:科学出版社.2003,84—103]
[15]Ralph P J,Gademann R.Rapid light curves:a powerful tool to assess photosynthetic activity[J].Aquatic Botany,2005,82(3):222—237
[16]Ling Q J.The influence of environmental stress on the growth and photosynthesis of Chlorella pyrenoidosa[D].Thesis for Master of Science,East China Normal University,Shanghai,2009[凌旌瑾.环境胁迫对蛋白核小球藻(Chlorella pyrenoidosa)生长和光合作用的影响.硕士学位论文,华东师范大学,上海.2009]
[17]Li X L,Geng Y H,Li Y G,et al.The advantages in competition based on the photosynthetic characteristics of Microcystis aeruginosa[J].Wuhan Botanical Research,2006,24(3):225—230[李小龙,耿亚红,李夜光.从光合作用特性看铜绿微囊藻(Microcystis aeruginosa)的竞争优势.武汉植物学研究,2006,24(3):225—230]
[18]Chan A T.Comparative physiological study of marine diatoms and dinoflagellates in relation to irradiance and cell size.II.Relationship between photosynthesis,growth,and carbon/chlorophyll a RATIO1,2[J].Journal of Phycology,1980,16(3):428—432
[19]Zhang Y B,Zhang J X,Zhang C X,et al.The spatial and temporal distribution of chlorophyll a and the influencing factors in Shenzhen Bay with frequent occurrence of red tide[J].Ecology and Environmental Sciences,2009,18(5):1638—1643[张瑜斌,章洁香,张才学,等.赤潮多发区深圳湾叶绿素a的时空分布及其影响因素.生态环境学报,2009,18(5):1638—1643]
[20]Ketchum B H.The absorption of phosphate and nitrate by illuminated cultures of Nitzschia closterium[J].American Journal of Botany,1939,26(6):399—407
[21]Vanliere L,Janse J H.Restoration and resilience to recovery of the lake loosdrecht ecosystem in relation to its phosphorus flow[J].Hydrobiologia,1992,233(1—3):95—104
[22]Klausmeier C A,Litchman E,Daufresne T,et al.Optimal nitrogen-to-phosphorus stoichiometry of phytoplankton[J].Nature,2004,429(6988):171—174
[23]Leonardos N,Geider R J.Effects of nitrate:phosphate supply ratio and irradiance on the C:N:P stoichiometry of Chaetoceros muelleri[J].European Journal of Phycology,2004,39(2):173—180
[24]Leonardos N,Geider R J.Responses of elemental and biochemical composition of Chaetoceros muelleri to growth under varying light and nitrate:phosphate supply ratios and their influence on critical N/P[J].Limnology and Oceanography,2004,49(6):2105—2114
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

