野生与人工养殖鲫鳃部寄生指环虫的群落结构
野生与人工养殖鲫鳃部寄生指环虫的群落结构
马幸荣1,2,3王桂堂1,3邹 红1吴山功1李文祥1,2
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 淡水水产健康养殖湖北省协同创新中心, 武汉 430072; 3. 中国科学院大学, 北京 100049)
为了阐明养殖环境对鱼类寄生指环虫群落的影响, 研究调查了湖北省梁子湖和湖北省石首市养殖池塘中鲫鳃部寄生指环虫的种类和感染情况。在梁子湖中的野生鲫共发现 6种指环虫, 分别为坏鳃指环虫(Dactylogyrus vastator)、中型指环虫(D. intermedius)、弧形指环虫(D. arcuatus)、弓茎指环虫(D. baueri)、美丽指环虫(D. formosus)、望外指环虫(D. inexpeatatus); 在养殖池塘中, 除了望外指环虫外, 其他5种指环虫均有发现。分析结果表明, 来自于梁子湖野生鲫鳃部的坏鳃指环虫的平均丰度以及其他 4种指环虫(不含望外指环虫)的感染率与平均丰度明显高于养殖池塘的。梁子湖中的指环虫群落平均物种丰富度、平均寄生虫数量以及 Brillouin多样性指数都明显高于养殖池塘的; 梁子湖野生鲫寄生指环虫的优势种是弧形指环虫(0.54), 而池塘中的是坏鳃指环虫(0.76)。在宿主密度、种群大小、光照和溶氧等影响指环虫群落的因子中, 溶氧可能是最主要因子。
鲫; 指环虫; 群落; 野生; 人工养殖
鱼类寄生虫群落与环境的关系受到生态学家的广泛关注[1—3]。对于鱼类体内的寄生蠕虫而言, 由于其生活史过程中经常需要中间宿主, 因此, 影响水体中中间宿主密度和数量的环境因素, 会间接影响体内寄生蠕虫的群落组成和多样性[2,4]。而对鱼类鳃部寄生的单殖吸虫来说, 由于它们不需要中间宿主, 由卵孵化的纤毛幼虫可直接感染鱼类[5], 因而,单殖吸虫的感染更容易受到环境因素的影响[6,7]。
在养殖条件下, 由于环境受到人工干扰较大,一般来说, 指环虫的种类会比较单调, 优势种群明显, 常引起养殖鱼类严重的病害; 而在自然水体中,尽管鱼类寄生指环虫的种类和数量都较高, 却很少引起病害的发生[8,9]。关于在野生与养殖环境中鱼类寄生单殖吸虫群落结构的差异, 国内外均有报道:通过调查中国南海大亚湾地区野生与养殖石斑鱼(Epinephelus)鳃部寄生单殖吸虫的群落组成以及变化特点, 发现在人工养殖模式下石斑鱼寄生单殖吸虫有较高的物种多样性和丰富度[10]; 在对土耳其北部锡诺普地区养殖与野生鲤(Cyprinus carpio)的体外寄生虫的调查中发现, 由于养殖池塘中有相对较高的鱼群密度, 其伸展指环虫(Dactylogyrus extensus)的感染率要高于野生鲤[11]。
鲫(Carassius auratus)是我国重要的养殖品种,随着养殖密度的提高和养殖环境的恶化, 指环虫病的发生日益严重和频繁, 给水产养殖带来巨大的经济损失, 成为水产养殖危害最严重的寄生虫病之一[12]。然而, 在我国的自然水体中, 鲫鳃部寄生的指环虫有8种之多[13], 但一般不引起鱼类的死亡。为弄清指环虫群落结构与环境的关系, 本实验调查了野生和养殖条件下鲫鳃部寄生指环虫的组成和多样性。
1 材料与方法
1.1 实验材料
2011年3月—2012年2月, 野生鲫每月取自于湖北省梁子湖(30°11′05.460″N, 114°37′33.984″E),人工养殖的鲫每月取自湖北省石首市老河四大家鱼国 家 级 原 种 场 的 养 殖 池 塘 (29°49′55.884″N, 112°28′39.552″)。梁子湖的鲫用电击或网簖捕捞, 池塘中鲫与四大家鱼混养, 鲫的初始放养密度为2000尾/667m2, 在整个养殖过程中只投喂人工饲料, 没有使用任何杀虫药物, 定期适当添加新水。每个月随机采集50尾左右的鲫, 运回实验室, 暂养于水族箱中, 在48h内完成寄生虫的检查。
1.2 寄生虫的鉴定和调查
将实验鱼麻醉(MS-222)后, 测量尾叉长, 并剪下鱼体两侧的鳃放在培养皿中, 滴少量的清水保持湿润, 然后把鳃小片分别剪开, 放在玻璃板上, 置于解剖镜下, 用解剖针分开鳃丝检查, 发现指环虫后, 用解剖针将其剥离, 再用吸管吸出, 放到载玻片上, 加上盖玻片直接在显微镜下进行观察, 或者用聚乙烯醇封片观察。
指环虫种类的鉴定主要是根据几丁质结构的后吸器(锚钩、联结片和边缘小钩)与交配器(交接管、支持器)的形状和大小[13,14]。掌握每种指环虫的主要特征后, 在解剖镜下可直接鉴定指环虫的种类, 并统计数量。
1.3 数据处理与统计分析
自然水体与养殖水体中鲫鳃部寄生指环虫群落分析在内群落(Infracommunity)水平上进行。感染率(Prevalence)、感染丰度(Abundance)、物种丰富度(Species richness)等术语参考Bush, et al.[15]。优势度指数用Berger-Parker指数(BP = Nmax/N, N是组分群落中所有寄生虫个体数量的总和, Nmax是感染丰度最大的一类寄生虫数量)。内群落多样性采用Brillouin指数[BI =(lnN!–∑lnni!)/N, ni为第i种寄生虫的数量, N为内群落中寄生虫个体数量的总和]。
2 结果
本研究共检查鲫1080条, 其中梁子湖553尾, 石首市老河渔场池塘527尾。平均体长分别为14.11 cm和17.70 cm (表1)。
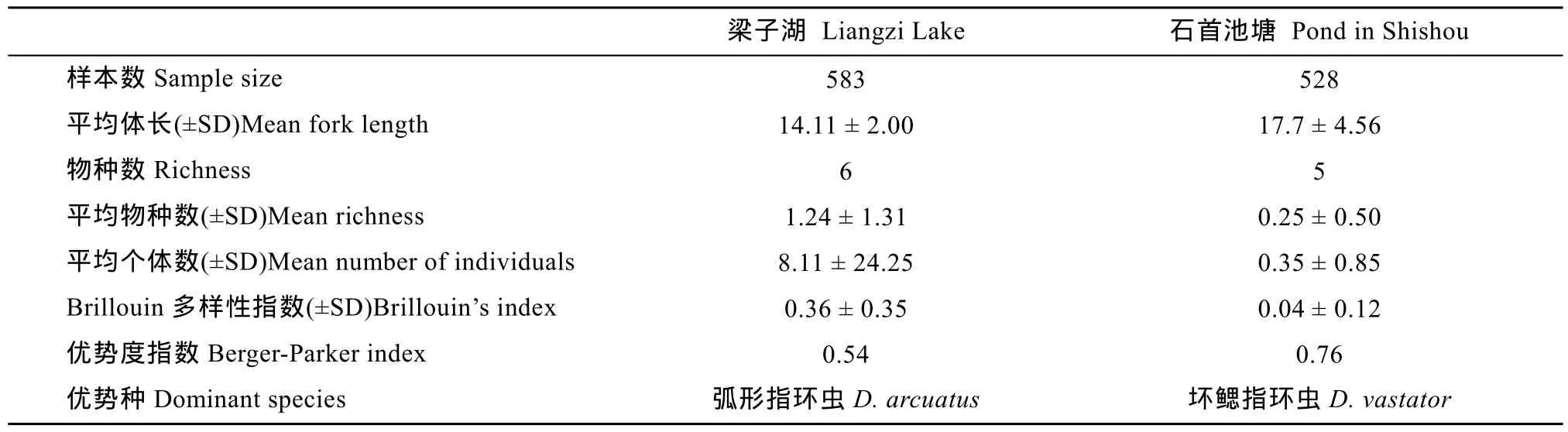
表1 梁子湖与石首养殖池塘鲫寄生指环虫群落结构特点Tab. 1 Characteristics of Dactylogyrus community on the gills of Carassius auratus in Liangzi Lake and a fish pond in Shishou city
在梁子湖的鲫中共发现6种指环虫, 分别为: 坏鳃指环虫(Dactylogyrus vastator)、中型指环虫(D. intermedius)、弧形指环虫(D. arcuatus)、弓茎指环虫(D. baueri)、美丽指环虫(D. formosus)、望外指环虫(D. inexpeatatus)。除了望外指环虫, 其他5种指环虫均在养殖池塘中发现。
统计分析发现, 来自于梁子湖野生鲫鳃部的坏鳃指环虫的平均丰度以及其他4种指环虫(不含望外指环虫)的感染率与平均丰度都显著高于养殖池塘的(P < 0.05), 只有梁子湖的坏鳃指环虫的感染率仅略高于养殖池塘(P > 0.05)(图1、图2)。
在梁子湖的鲫中, 中型指环虫的感染率最高(41.51%), 弧形指环虫的平均丰度最高(4.39), 而望外指环虫感染率与平均丰度都很低, 分别为0.85%和0.012。在养殖池塘鲫中, 各指环虫的感染率和平均丰度都较低, 其中感染率和平均丰度最高的是坏鳃指环虫, 分别为18.02%和0.27±0.76, 最低的是美丽指环虫, 为0.30%。
梁子湖中寄生鲫鳃部的指环虫群落的平均物种丰富度(1.24±1.31)明显高于石首养殖池塘的(0.25±0.50), 每条鱼的平均寄生虫数量和 Brillouin多样性指数都是梁子湖的明显高于池塘中的, 梁子湖的优势种是弧形指环虫(0.54), 而池塘中的是坏鳃指环虫(0.76)(表1)。
3 讨论
梁子湖鲫寄生指环虫的物种丰富度和多样性都明显高于石首养殖池塘的。Karvonen, et al.在对芬兰不同池塘和湖泊的鲫寄生虫群落进行调查时发现,较少的鱼类种类和数量、极端的生存环境和寄生虫对宿主的不适应是导致池塘中鲫寄生虫群落多样性和丰富度较低的主要原因[16]。但是, 有研究发现在人工养殖模式下石斑鱼寄生单殖吸虫有较高的物种多样性和丰富度[10], 这可能与该实验的采样有关,石斑鱼养殖在塑料箱和水泥池中, 保证了较好的水质条件, 而且养殖的石斑鱼都是从野外捕获来补充的。对于指环虫来说, 由于较强的宿主特异性, 其他鱼类一般不会影响鲫鳃部指环虫的感染, 养殖池塘较差的生存环境可能是导致指环虫群落多样性较低的主要原因。

图1 梁子湖与石首养殖池塘鲫寄生指环虫的平均丰度Fig. 1 Mean abundances of Dactylogyrus on the gills of Carassius auratus in Liangzi Lake and a fish pond in Shishou city

图2 梁子湖与石首养殖池塘鲫寄生指环虫的感染率Fig. 2 Prevalences of Dactylogyrus on the gills of Carassius auratus in Liangzi Lake and a fish pond in Shishou city
在养殖池塘中, 鲫各种指环虫的平均丰度明显低于野生条件下的, 这与很多研究结果不同。在对印度尼西亚野生与养殖水体中的石斑鱼寄生虫区系进行调查时发现, 养殖水体中单殖吸虫的丰度明显高于野生环境中的[17]; 对埃及养殖和野生水体中的尼罗罗非鱼(Oreochromis niloticus)寄生虫区系调查时发现, 养殖水体中的单殖吸虫的丰度同样要高于野生环境中的, 认为养殖水体中鱼类密度较大, 纤毛幼虫感染宿主的机率增加等是导致单殖吸虫丰度增高的原因[18]。
宿主和寄生虫的密度以及它们的空间分布是影响寄生虫传播的重要因素[19], 当宿主密度在一定阈值内时, 密度越大, 寄生虫与宿主接触的机会越多,寄生虫感染的机率越大[20]。但是也有研究通过对不同池塘鲫寄生虫调查中发现, 影响寄生虫物种平均丰度的是宿主种群的大小而非宿主密度, 认为当在野生环境与养殖池塘中, 鲫的密度足够大, 均达到指环虫感染的阈值时, 宿主的种群大小对指环虫感染则起着决定性的作用[21]。鲫是梁子湖中常见鱼类[22],密度较大, 而在石首的养殖池塘中, 鲫的密度也在2尾/m2以上, 两种水体中鲫的密度可能均达到指环虫传播的阈值, 但是梁子湖中鲫种群显然要大于养殖池塘中的, 这可能是梁子湖中鲫寄生指环虫的平均丰度显著高于养殖池塘的原因之一。
鱼类指环虫的传播不需要中间宿主, 由卵孵化的纤毛幼虫可直接感染鱼类[5], 因此, 单殖吸虫的感染更容易受到环境因素的影响[6,7]。在养殖水体中由于投喂大量的饲料, 富营养化程度明显高于自然水体中的, 富营养化通常会造成水体的透明度和池塘底部溶氧浓度降低[23,24], 而水体中光线和溶氧可能是影响单殖吸虫感染和传播的重要因素[25,26]。单殖吸虫的幼虫存在两个时期, 纤毛幼虫的前期具有强趋光性, 且此时幼虫尾部的锚钩尚未打开, 没有感染宿主的能力; 而纤毛幼虫的后期具有较强的背光性, 这个时期具有感染能力, 研究表明在阳光直接照射下, 坏鳃指环虫与伸展指环虫对鲤的感染强度均下降[27]。养殖池塘中水体的透明度明显低于梁子湖, 但是指环虫的感染丰度却明显低于梁子湖的,由此推测, 光照并不是影响养殖池塘中指环虫感染丰度较低的原因。另外, 指环虫对溶氧变化比较敏感, 如伸展指环虫对低氧压反应敏感, 水体中溶氧的下降能显著地降低其种群大小[27]。调查发现, 冬季D. simplicimalleata 感染欧飘鱼(Pelecus cultratus)但是不会感染东方欧鳊(Abramis brama), 可能是因为这两种鱼越冬时处于不同溶氧水平的水体中[28]。因此, 池塘水体较低的溶氧可能也是造成指环虫丰度较低的原因之一。
梁子湖的优势物种是弧形指环虫, 而养殖池塘中的是坏鳃指环虫, 可能是由于水环境的改变, 使得坏鳃指环虫更适合养殖环境。在地中海地区的鲤鱼养殖场, 坏鳃指环虫传播迅速, 对鱼苗影响较大[29]。因此, 虽然坏鳃指环虫的感染率和丰度在我们此次的池塘调查中均不高, 但已形成优势种群, 因此推测它对池塘养殖的鲫具有潜在威胁。
[1] Bush A O, Aho J M, Kennedy C R. Ecological versus phylogenetic determinants of helminth parasite community richness [J]. Evolutionary Ecology, 1990, 4(1): 1—20
[2] Kennedy C. Freshwater fish parasites and environmental quality: An overview and caution [J]. Parassitologia, 1997, 39(3): 249—254
[3] Leong T, Holmest J. Communities of metazoan parasites in open water fishes of Cold Lake, Alberta [J]. Journal of Fish Biology, 1981, 18(6): 693—713
[4] Poulin R, Valtonen E. Interspecific associations among larval helminths in fish [J]. International Journal for Parasitology, 2001, 31(14): 1589—1596
[5] Llewellyn J. Larvae and larval development of monogeneans [J]. Advances in Parasitology, 1968, 6: 373—383
[6] Koskivaara M, Valtonen E T. Dactylogyrus (Monogenea) Communities on the Gills of Roach in 3 Lakes in Central Finland [J]. Parasitology, 1992, 104(2): 263—272
[7] Koskivaara M, Valtonen E T, Prost M. Dactylogyrids on the gills of roach in central Finland: Features of infection and species composition [J]. International Journal for Parasitology, 1991, 21(5): 565—572
[8] Saunders R L. Potential interaction between cultured and wild Atlantic salmon [J]. Aquaculture, 1991, 98(1—3): 51—60
[9] Thoney D A, Hargis Jr W J. Monogenea (platyhelminthes) as hazards for fish in confinement [J]. Annual Reviews of Fish Diseases, 1991, 1: 133—153
[10] Luo Y F, Yang T B. Seasonal patterns in the community of gill monogeneans on wild versus cultured orange-spotted grouper, Epinephelus coioides Hamilton, 1822 in Daya Bay, South China Sea [J]. Aquaculture Research, 2012, 43(8): 1232—1242
[11] Özer A. The relationship between occurrence of ectoparasites, temperature and culture conditions: a comparison of farmed and wild common carp (Cyprinus carpio L., 1758) in the Sinop region of northern Turkey [J]. Journal of Natural History, 1999, 33(4): 483—491
[12] Guo F C, Woo P T K. Selected parasitosis in cultured and wild fish [J]. Veterinary Parasitology, 2009, 163(3): 207—216
[13] Chen C L. An illustrated guide to the fish disease and causative pathogenic fauna and flora in the Hupei Province [M]. Beijing: Science Press. 1973, 117—119 [陈启鎏. 湖北省鱼病病原区系图志. 北京 : 科学出版社. 1973, 117—119]
[14] Gusev A V. Keys to Parasites of Freshwater Fish of the U S S R [M]. Parasitic Metazoa, Leningrad, Nauka. 1985, 2
[15] Bush A O, Lafferty K D, Lotz J M, et al. Parasitology meets ecology on its own terms: Margolis et al. revisited [J]. The Journal of Parasitology, 1997, 83(4): 575—583
[16] Karvonen A, Bagge A M, Valtonen E T. Parasite assemblages of crucian carp (Carassius carassius) is depauperate composition explained by lack of parasite exchange, extreme environmental conditions or host unsuitability [J]? Parasitology, 2005, 131(2): 273—278
[17] Rückert S, Klimpel S, Palm H W. Parasites of cultured and wild brown-marbled grouper Epinephelus fuscoguttatus (Forsskal, 1775) in Lampung Bay, Indonesia [J]. Aquaculture Research, 2010, 41(8): 1158—1169
[18] Ibrahim M M, Soliman M F. Parasite community of wild and cultured Oreochromis niloticus from Lake Manzalah, Egypt [J]. Journal of the Egyptian Society of Parasitology, 2011, 41(3): 685—697
[19] Nie P. A brief review on the population ecology of parasites [J]. Acta Hydrobiologica Sinica, 1990, 14(4): 359—367 [聂品. 寄生虫种群生态研究的综述. 水生生物学报, 1990, 14(4): 359—367]
[20] Arneberg P, Skorping A, Grenfell B, et al. Host densities as determinants of abundance in parasite communities [J]. Proceedings of the Royal Society of London Series B-Biological Sciences, 1998, 265(1403): 1283—1289
[21] Bagge A M, Poulin R, Valtnen E T. Fish population size, and not density, as the determining factor of parasite infection: a case study [J]. Parasitology, 2004, 128(3): 305—313
[22] Chen P X. An ecological study of Carassius auratus in Lake Liang-Tze [J]. Acta Hydrobiologica Sinica, 1959, (4): 411—419 [陈佩薰. 梁子湖鲫鱼的生物学研究. 水生生物学集刊, 1959, (4): 411—419]
[23] Boyd C E, Tucker C S. Water Quality and Pond Soil Analyses for Aquaculture [M]. Auburn University, Alabama Agricultural Experiment Station in Auburn, Ala. 1992, 188
[24] Chang W Y B, Ouyang H. Dynamics of dissolved oxygen and vertical circulation in fish ponds [J]. Aquaculture, 1988, 74(3): 263—276
[25] Chubb J C. Seasonal occurrence of helminths in freshwaterfishes. Part I. Monogenea [J]. Advances in Parasitology, 1977, 15: 133—199
[26] Xia X Q, Wang W J. The biology and ecology of Monogenea [J]. Acta Hydrobiologica Sinica, 1997, 21(1): 75—84 [夏晓勤, 王伟俊. 单殖吸虫生物学及生态学. 水生生物学报, 1997, 21(1): 75—84]
[27] Bychowsky B E. Monogenetic trematodes, their classification and phylogeny [J]. Moscow: Lenigrad. Academy of Sciences, U. S. S. R (in Russian), 1957
[28] Izyumova N. Seasonal dynamics of the parasites of fish in the Rybinsk water reservoir [J]. Trudy Biologicheskoy Stantsii ‘Borok’, Moscow (in Russian), 1958, 3: 384—398
[29] Paperna I. Dynamics of Dactylogyrus vastator Nybelin (Monogenea) populations on the gills of carp fry in fish ponds [J]. Bamidgeh Bull Fish Cult Israel (in Russian), 1963, 5: 31—50
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

